Implant Nha khoa đã trở nên thành công nhờ khám phá ra các đặc tính sinh học và cơ học của titan [ 35 ]. Nhiều nghiên cứu báo cáo rằng một số yếu tố, bao gồm thiết kế đại thể implant, xử lý bề mặt của implant (với mức độ Macro, Micro và nano-), khả năng ái nước / năng lượng, tính ưa nước hoặc tính kỵ nước, điện tích và hóa học, dường như ảnh hưởng đến các giai đoạn viêm và giai đoạn tái sinh xảy ra trong quá trình tích hợp liên kết.
Bài viết này đánh giá một số phương pháp cơ bản về xử lý bề mặt và ảnh hưởng của chúng đối với Implant titan (Ti). Tầm quan trọng của mỗi phương pháp điều trị và tác dụng của nó sẽ được thảo luận chi tiết để so sánh hiệu quả của chúng trong việc thúc đẩy quá trình tích hợp xương. Các tài liệu đã xuất bản trong 18 năm qua đã được lựa chọn với việc sử dụng các từ khóa như titanium detnal implant, độ nhám bề mặt, lớp phủ và tích hợp xương. Độ nhám bề mặt đóng một vai trò đáng kể quan trọng làm tăng diện tích bề mặt tiếp xúc implant với mô xương, tăng sinh tế bào và chống lại mô-men xoắn, mặc dù có tính chất cơ học tốt.
Nhìn chung, các nghiên cứu đã công bố chỉ ra rằng bề mặt implant được soi mòn bằng axit tạo nhám và ứng dụng tạo lớp phủ trên implant làm bằng titan nguyên chất thương mại thích hợp nhất trong việc tạo ra độ nhám bề mặt tốt. Do đó, sự kết hợp giữa độ nhám bề mặt tốt và các đặc tính cơ học của titan có thể dẫn đến việc implant răng thành công.
- Giới thiệu
Xử lý bề mặt thường được thực hiện để sửa đổi nhưng vẫn duy trì các đặc tính mong muốn của vật liệu nền, đặc biệt là trong ngành implant nha khoa. Diện tích bề mặt có thể được tăng lên đáng kể bằng cách sử dụng các kỹ thuật xử lý thích hợp, bằng các quy trình đắt thêm hoặc bào mòn [ 1 , 2 ]. Xử lý bề mặt cũng có thể được phân loại thành các phương pháp cơ học, hóa học và vật lý. Trong implant nha khoa, xử lý bề mặt được sử dụng để thay hình thái bề mặt và điện tích bề mặt, dẫn đến cải thiện khả năng thấm ướt [ 3 – 5 ], giúp thúc đẩy sự tăng sinh tế bào [ 3 ], đồng thời tăng tốc quá trình tích hợp xương [ 6]. Chất lượng của implant nha khoa phụ thuộc vào đặc tính của bề mặt. Để có sự tương tác tốt giữa mô và sự tích hợp xương , tính tương thích sinh học của vật liệu và độ nhám của bề mặt đóng một vai trò quan trọng. Goyal và các đồng nghiệp [ 7 ] quan sát thấy rằng độ nhám tăng lên có thể đồng thời làm tăng diện tích bề mặt của implant, cải thiện sự di chuyển và gắn kết của tế bào với implant, đồng thời tăng cường quá trình tích hợp xương. Các tài liệu trước đây cho thấy hầu hết các phương pháp xử lý bề mặt có thể mang lại hiệu quả tốt cho việc implant răng [ 3 – 6 ]. Xử lý bề mặt bằng cách dắp thêm được chứng minh là làm tăng đáng kể diện tích bề mặt của implant [ 8 ]. Bề mặt được xử lý bằng titan phun plasma thể hiện giá trị cao nhất của độ nhám bề mặt (3.43 ± 0.63 μ m) so với bề mặt làm nhám bằng máy (0.15 ± 0.04 μ m) [ 9 ]. Giai đoạn lành vết thương được tăng cường với lớp phủ hydroxyapatite (HA) so với không có lớp phủ [ 10 ]. Nghiên cứu trên bề mặt implant bằng nuôi cấy tế bào cho thấy bề mặt implant zirconia được tạo nhám bằng axit cho thấy sự cải thiện đáng kể trong quá trình tăng sinh tế bào, ngoại trừ sự gắn kết và kết dính của xương vào ngày đầu tiên của quá trình nuôi cấy [ 11 – 13 ]. Trong nghiên cứu của Parsikia et al. [ 14 ], bề mặt titan tinh khiết thương mại được thổi cát sau khi xử lý hóa học hai bước (axit-kiềm) dẫn đến độ nhám bề mặt được tối ưu hóa. Hoạt tính sinh học của tế bào đã được cải thiện và đạt được sự tích hợp xương ngay ở giai đoạn sớm. Hơn nữa, bề mặt titan thô hơn thúc đẩy quá trình tích hợp xương nhanh hơn [ 15 ] so với bề mặt mịn. Do đó, xử lý bề mặt không chỉ được sử dụng để duy trì các đặc tính hiện có của implant mà còn để tăng cường một số yêu cầu ứng dụng trong nha khoa, đặc biệt là trong việc cải thiện quá trình lành thương. - Tổng quan
- Titanium Implant:
Titan là vật liệu được lựa chọn để cắm ghép khoa vì các đặc tính của nó đáp ứng các yêu cầu quan trọng nhất như tính tương thích sinh học tuyệt vời [ 16 ], chống ăn mòn, độ bền cao và mô đun đàn hồi tương đối thấp [ 17 ], khả năng định hình tốt và khả năng gia công. Ngoài ra, các sửa đổi bề mặt đang được sử dụng trên các bề mặt implant, chủ yếu để cải thiện khả năng ái nước, độ bám dính và gắn kết của tế bào với implant, tăng sinh tế bào và tích hợp xương, do đó giúp lành thương nhanh hơn và giúp nhắn thời gian điêu trị. Nhiều công trình nghiên cứu đã được thực hiện nhằm cải thiện các chỉnh sửa bề mặt trên implant hiện có để đạt được các phản ứng sinh học mong muốn. Hình thái bề mặt cũng đã được xử lý như ăn mòn axit và thổi nhám [ 18] lên bề mặt để có được hình thái bền mặt tốt hơn, do đó mang lại độ nhám tốt hơn. Về mặt cơ sinh học, độ nhám của implant titan được coi là một trong những thông số quan trọng ảnh hưởng đến tốc độ và chất lượng của quá trình tích hợp xương [ 15 , 18 , 19 ]. Khả năng tương thích sinh học của Titan và các hợp kim của nó
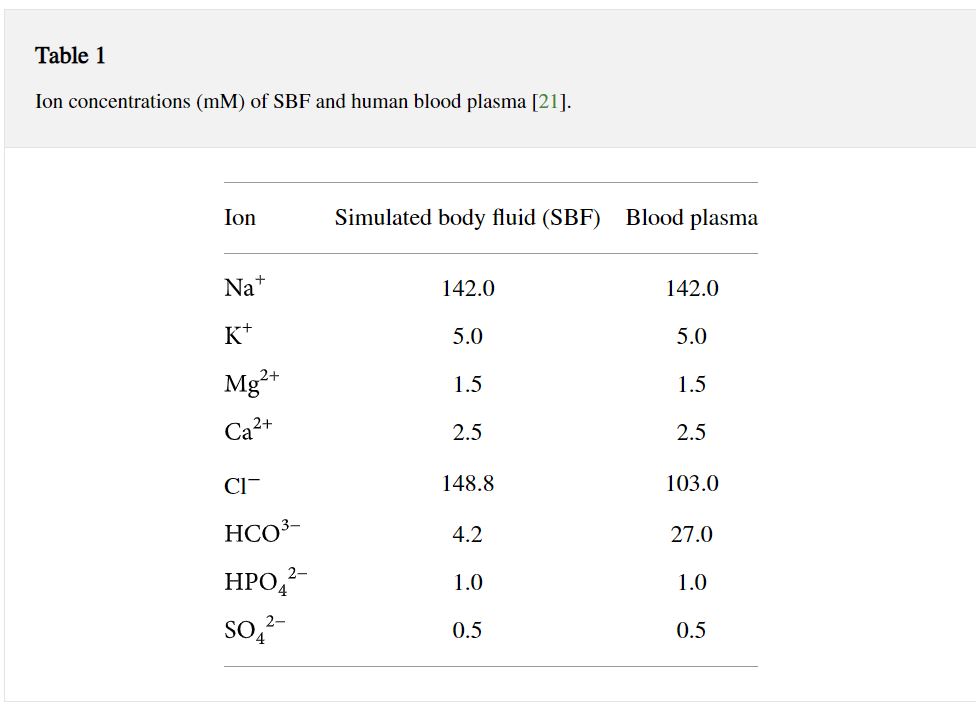
Sự tương thích của vật liệu là vấn đề quan trọng nhất cần được xem xét để có một ca implant implant đạt được thành công. Titan và các hợp kim của nó được biết đến là vật liệu được các mô sống dung nạp tốt và có khả năng thúc đẩy quá trình tích hợp xương [ 20 ]. Lý tưởng nhất là việc xử lý bề mặt implant để tăng cường sự tích hợp liên kết giữa các vật liệu và mô xương. Các bề mặt của vật liệu sau khi xử lý phải có khả năng tương tác với các mô xung quanh để tạo ra sự tiếp xúc trực tiếp của xương với implant. Điều trị Kokubo, còn được gọi là dịch cơ thể mô phỏng (SBF) Kokubo treatment, also known as simulated body fluid (SBF), là một phương pháp hóa học để tạo ra hoặc xác định mức độ tương thích sinh học của vật liệu nha khoa được thành lập vào năm 1991 [ 21]. SBF có thể được mô tả như một dung dịch có nồng độ ion tương tự như huyết tương người (xem Bảng 1 ), được giữ trong điều kiện pH nhẹ và nhiệt độ sinh lý giống hệt nhau [ 21 ]. Lịch sử sử dụng SBF để hình thành apatit được thể hiện trong Hình 1 [ 21 – 25 ]. Vào đầu năm 1980, Ogino và các đồng nghiệp [ 22 ] đã tìm thấy lớp silicon dioxide (SiO 2 ) và canxi photphat (CaP) được hình thành trên Bioglass cho phép liên kết với xương sống. Năm 1990, Kokubo et al. [ 24] đã tuyên bố rằng sự hình thành của apatit là yếu tố cần thiết cho sự tích hợp tự liên kết giữa bề mặt implant và xương sống. Việc chuẩn bị đầy đủ SBF đã được báo cáo vào năm 1995 bởi Cho et al. [ 25 ].


Hoạt tính sinh học được nghiên cứu trên in vivo và in vitro của vật liệu có thể được dự đoán từ sự hình thành apatit trên bề mặt của nó trong môi trường SBF [ 26 ]. Tình trạng xử lý bền mặt, chẳng hạn như độ nhám bề mặt, điện tích bề mặt, năng lượng bề mặt và thành phần hóa học, có những ảnh hưởng quan trọng đến quá trình tích hợp liên kết. Do đó, sửa đổi bề mặt implant titan dường như là một cách đầy hứa hẹn để đạt được sự tích hợp xương của implant nhanh hơn và mạnh hơn, đồng thời thúc đẩy thời gian lành thương ngắn hơn từ khi đặt đến khi phục hình [ 27 ].- Xử lý bề mặt
Gần đây, nhiều công trình đã được thực hiện về implant titan thương mại đã được xử lý bề mặt để tăng cường chức năng tích hợp xương (tài liệu tham khảo). Bằng cách tăng độ nhám bề mặt, người ta đã quan sát thấy sự gia tăng tỷ lệ tích hợp xương và sự cố định cơ sinh học của implant titan [ 27 , 28 ]. Có thể đạt được bằng các sửa đổi trên implant bằng phương pháp thêm vào hoặc lấy đi. Các phương pháp thêm vào bền mặt implant sử dụng nhiều loại vật liệu khác nhau với cách xử lý thêm vào khác nhau như được phân loại thành lớp phủ và lớp ngâm tẩm, tương ứng. Trong khi việc ngâm tẩm ngụ ý rằng vật liệu / tác nhân hóa học được tích hợp hoàn toàn vào lõi titan, chẳng hạn như tinh thể lớp canxi photphat trong TiO 2 hoặc sự kết hợp của các ion florua vào bề mặt, mặt khác, lớp phủ là sự bổ sung của vật liệu / tác nhân có độ dày khác nhau trên bề mặt của vật liệu lõi. Các kỹ thuật phủ có thể bao gồm phun plasma titan (TPS), phủ hydroxyapatite (HA) phun plasma, phủ alumina và phủ phỏng sinh học canxi photphat (CaP) .
Trong khi đó, các kỹ thuật lấy bớt là quy trình loại bỏ lớp vật liệu lõi hoặc làm biến dạng dẻo bề mặt bề mặt và do đó làm thô ráp bề mặt vật liệu lõi. Các kỹ thuật trừ phổ biến là thổi cát sạn lớn hoặc hạt sứ lên bề mặt,soi mòn axit, và anot hóa [ 19]. Việc loại bỏ vật liệu bề mặt bằng các phương pháp cơ học liên quan đến việc tạo hình / loại bỏ, mài, gia công hoặc phun hạt thông qua lực vật lý. Xử lý hóa học, bằng cách sử dụng axit hoặc sử dụng dung dịch kiềm của hợp kim titan nói riêng, thường được thực hiện không chỉ để thay đổi độ nhám bề mặt mà còn để thay đổi thành phần và tạo ra khả năng ái nước hoặc năng lượng bề mặt của bề mặt the ( the surface energy of the surface ) [ 29 ]. Còn đối với xử lý vật lý như phun plasma hoặc phun nhiệt, thường được tiến hành trên bề mặt phủ bên ngoài để nâng cao tính thẩm mỹ của vật liệu và tính năng của nó. Ngoài ra, ion hóa implant, xử lý bề mặt bằng laser và phun xạ [ 10 , 30 – 33 ], ăn mòn kiềm / axit [ 34 – 36], và sự lắng đọng ion [ 37 ] cũng được sử dụng. Do đó, dưới góc độ nghiên cứu ảnh hưởng của các phương pháp xử lý bề mặt, bài tổng quan này chỉ tập trung vào các phương pháp khác nhau có tiềm năng cao trong việc cải thiện hiệu suất của implant titan. Nguyên tắc cơ bản của mỗi sửa đổi bề mặt và sự phát triển của nó được thảo luận trong các phần sau:- Tiền xử lý
Trước khi tiến hành sửa đổi bề mặt, cần phải xử lý sơ bộ để đảm bảo bề mặt nền không bị nhiễm bẩn. Trước khi thủ tục phun plasma, các chất nền thường được xử lý sơ bộ bằng thổi cát hạt lớn [ 38 , 39 ] để loại bỏ các tạp chất bề mặt và nhám (phạm vi độ nhám 3-5 μ m) bề mặt để có được độ bám dính tốt hơn giữa chất nền và bột [ 40 ] . Nền cũng có thể được gia nhiệt trước để giảm ứng suất dư và tránh nứt lớp phủ [ 38 ]. Đối với phương pháp ăn mòn axit, bề mặt được chuẩn bị bằng cách đánh bóng với một vài giấy nhám [ 41 ] để đạt được sự đồng nhất [ 42 ] và hình thái đều đặn của bề mặt [ 43]. Độ nhám bề mặt điển hình thu được từ quá trình đánh bóng nằm trong khoảng ~ 0,1 [ 44 , 45 ] đến 3 μ m [ 43 ]. Hình 2 cho thấy các hình thái điển hình của hợp kim Ti được đánh bóng bằng cách sử dụng giấy mài silic cacbua (SiC). Tóm lại, quy trình tiền xử lý là rất quan trọng vì nó cung cấp bề mặt sạch sẽ, bằng cách loại bỏ các khuyết tật không mong muốn như vết xước và các vết bất thường.

- Tiền xử lý
- Titanium Implant:
- Phân loại các phương pháp xử lý bề mặt
- Phun phủ Plasma
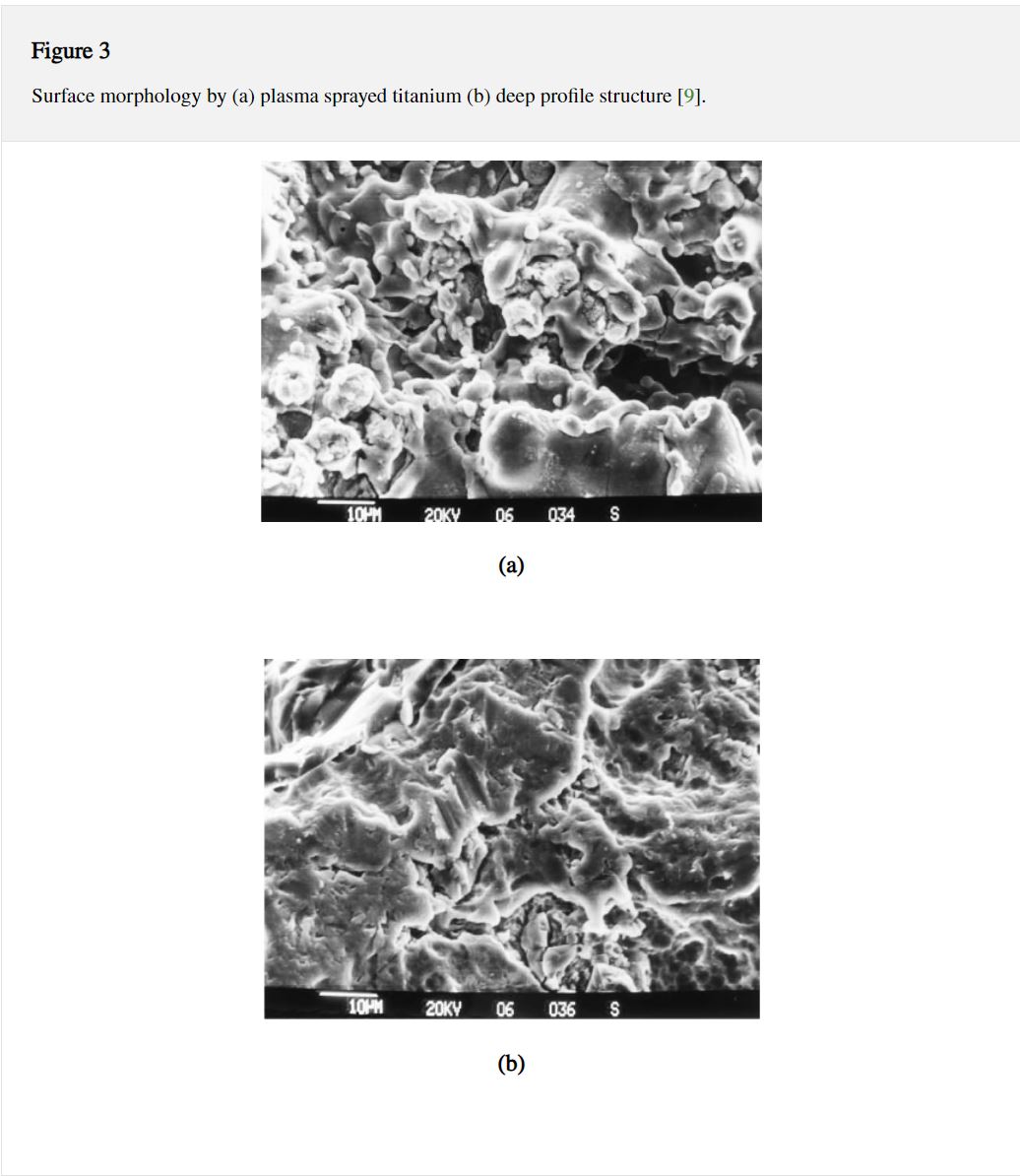
Kỹ thuật phun plasma thường bao gồm lớp lắng đọng dày, chẳng hạn như hydroxyapatite (HA) và titan (Ti). Quá trình phủ bao gồm phun các vật liệu được nung chảy bằng nhiệt lên các chất nền của implant . Sự kết hợp của lớp phủ HA trên nền hợp kim Ti đã nhận được nhiều sự quan tâm do các đặc tính hấp dẫn của chúng như tính tương thích sinh học và cơ học tốt [ 32 ]. Việc phun plasma về cơ bản đã làm tăng đáng kể diện tích bề mặt của các implant bằng cách tăng độ nhám bề mặt của chúng [ 46 ]. Tiềm năng của lớp phủ phun plasma phun để tăng cường tính chất cơ học đã được nhiều nghiên cứu đưa ra [ 9 , 17 , 18 , 31 , 37 , 38]. Một số kỹ thuật đã được đề xuất để kết dính HA với implant titan [ 9 , 10 , 17 ], nhưng chỉ có kỹ thuật phun plasma được sử dụng thành công trên implant thương mại [ 19 ]. Dung dịch canxi photphat có khả năng di căn cung cấp hoạt tính sinh học tuyệt vời của lớp phủ composite HA / YSZ / Ti-6Al-4V, có khả năng tạo ra sự phát triển và tạo mầm apatit giống như xương trên bề mặt implant [ 38 ]. Fouda và cộng sự. [ 10 ] báo cáo rằng implant titan phủ HA có thể tăng cường thời gian lành thương so với implant không phủ. Xie và cộng sự. [ 33] cũng phát hiện ra rằng lớp phủ HA thúc đẩy sự tăng sinh tế bào tốt hơn. Tuy nhiên, trong một số trường hợp, tác dụng ngược của lớp phủ HA [ 47 , 48 ] cũng được ghi nhận. Theo Liu và cộng sự. [ 49 ], độ bền liên kết của HA trên hợp kim titan làm giảm thời gian ngâm nhiều giờ trong chất lỏng cơ thể mô phỏng (SBF). Yang và cộng sự. [ 48 ] cũng báo cáo rằng sau khi ngâm trong SBF, lớp phủ hydroxyapatite (HA) trở nên yếu do sự suy giảm liên kết giữa các sao hoặc liên kết cố kết trong lớp phủ. Tuy nhiên, Knabe et al. [ 9 ] phát hiện ra rằng bề mặt được phun titan plasma thể hiện độ nhám bề mặt cao nhất so với cấu trúc bề mặt có bề mặt lõm sâu (bề mặt được soi mòn axit và thổi cát ; xem Hình 3) và trong một thử nghiệm trong ống nghiệm, lớp phủ HA ít tiếp xúc với xương hơn so với các sửa đổi bề mặt khác. Một số báo cáo cho thấy rằng các tính chất cơ học của HA có thể được cải thiện đáng kể bằng cách bổ sung zirconia ổn định yttria (yttria-stabilized zirconia )[ 40 , 50 ]. Nghiên cứu trước đây [ 51 ] báo cáo rằng các lớp phủ HA được gia cố bằng zirconia có hiệu suất tốt hơn về độ bền liên kết và hành vi hòa tan của implant titan. Trong cùng khoảng thời gian (4 tuần sau khi ngâm SBF), lớp phủ composite HA / YSZ / Ti-6Al-4V cho thấy độ bền kéo giảm ~ 27,7% so với lớp phủ HA nguyên chất là ~ 78,8% [ 38]. Người ta đã báo cáo rằng nhiều xương mới được hình thành và phát triển nhanh hơn vào các lỗ trên bề mặt của implant được phun plasma biến tính kiềm, và điều này có thể có lợi để giảm thời gian lành thương trên lâm sàng và do đó cải thiện tỷ lệ thành công của implant [ 52 ].

Thổi cát
Một cách khác để làm nhám bề mặt là thổi cát, thông qua chiếu hạt có áp suất hoặc sử dụng vật liệu ceramic hoặc silica lên bề mặt implant. Các vật liệu như cát, hydroxyapatit, alumin hoặc hạt TiO 2 thường được sử dụng cho cùng mục đích [ 35 , 36 ]. Quá trình phun hạt luôn được thực hiện sau quá trình ăn mòn axit để loại bỏ các hạt còn sót lại. Do đó, thổi cát cũng được coi là một trong những phương tiện để nhúng các chất bẩn bề mặt lên chất nền [ 51 ]. Độ cứng siêu nhỏ bề mặt của các hạt zirconia trên bề mặt titan thông qua quá trình thổi áp lực được phát hiện là lớn hơn nhiều so với bề mặt titan được đánh bóng có kiểm soát [ 19 ]. Al-Radha và đồng nghiệp [ 53] đã đánh giá ảnh hưởng của sự bám dính của vi khuẩn trên một số imlant titan với các phương pháp điều trị khác nhau. Kết quả cho thấy titan được phun ZrO 2 có khả năng bám dính vi khuẩn cao hơn so với các phương pháp xử lý bề mặt khác. Trong một trường hợp tương tự, Aparicio et al. [ 34 ] áp dụng alumina phun áp lực với kích thước hạt khác nhau, 425-600 μ m để đạt được giá trị cao của độ nhám bề mặt giữa 4.15 ± 0.26 μ m. Các nghiên cứu in vivo của Bacchelli et al. [ 54 ], họ phát hiện ra rằng titan lắng đọng được xử lý bằng Ti tinh khiết thương mại cho thấy độ nhám bề mặt cao nhất là 8.55 ± 0.78 μ m, tiếp theo là ZrO 2 phun cát với quá trình tích hợp xương được cải thiện. Điều này chỉ ra rằng phương pháp thổi hạt áp lực cũng có vai trò hiệu quả trong việc tạo độ nhám tối ưu cho bề mặt implant răng [ 3 ]. Tuy nhiên, kỹ thuật này chỉ có triển vọng ở bề mặt tốt chứ không có khả năng tự liên kết. Bên cạnh đó, vi khuẩn sẽ có xu hướng tích tụ nhiều hơn trên bề mặt nền nhám so với bề mặt nền nhẵn. Do đó, phải tiến hành nghiên cứu sâu hơn về cách kỹ thuật này ảnh hưởng đến các đặc tính quan trọng như tiếp xúc với implant ghép xương, loại bỏ giá trị mômen xoắn , phản ứng của mô, độ bám dính của vi khuẩn và tính tương thích sinh học.
Soi mòn Acid
Trong quá trình ăn mòn bằng axit, việc sử dụng axit trên bề mặt kim loại không chỉ để làm sạch bề mặt mà còn để sửa đổi độ nhám. Một axit mạnh như hydrofluoric (HF), nitric (HNO 3 ) và sulfuric (H 2 SO 4 ) hoặc sự kết hợp của các axit này thường được sử dụng trong kỹ thuật này. Các bề mặt được soi mòn bằng axit đã làm tăng độ kết dính của tế bào và sự hình thành xương, do đó tăng cường sự tích hợp xương [ 3 , 49 – 51 , 53 , 54 , 59 – 62 ]. Do khả năng hòa tan của nó [ 63 , 64], HF đã được sử dụng để soi mòn các vật liệu sứ phục hồi nhằm tăng bề mặt liên kết cho các chất kết dính. Tầm quan trọng của kỹ thuật này cũng làm cho nền có độ nhám đồng nhất bất kể kích thước và hình dạng [ 63 ]. Độ nhám của titan là một trong những yếu tố giúp xác định sự ổn định của quá trình hình thành và tiêu xương tại bề mặt tiếp xúc của mô xương và implant [ 65 ]. Alla và cộng sự. [ 66 ] báo cáo bàng phương pháp chụp quang học nano (nanotopography) cho phép xương ăn sâu qua quá trình soi mòn axit trên implant có thể cải thiện độ gồ ghề. Nghiên cứu trước đây đã báo cáo rằng tốc độ ăn mòn phụ thuộc vào loại và nồng độ của axit được sử dụng [ 35]. Tuy nhiên, mức độ phù hợp của các axit này trong quá trình ăn mòn không được xác định vì chúng yêu cầu các thử nghiệm sâu hơn, đặc biệt là về sự tiếp xúc của implant mô xương và loại bỏ mô-men xoắn. Các mẫu titan được soi mòn bởi H 2 SO 4 với các nồng độ khác nhau cho thấy sự gia tăng độ nhám bề mặt [ 57 ]. H 2 SO 4 đậm đặc đã được chứng minh là một giải pháp hiệu quả để làm nhám bề mặt, đặc biệt cho các ứng dụng sinh học [ 66 ].
Soi mòn Acid kép (DAE)
Tương tự như ăn mòn axit, DAE cũng có thể xử lý bề mặt thông qua hóa chất hoặc axit theo trình tự lần lượt [ 45 ] hoặc với sự kết hợp của cả hai [ 67 , 68 ]. Quá trình hòa tan nhanh chóng có thể đạt được bằng cách soi mòn kép thông qua bề mặt nhám vi mô [ 55 ]. Một nghiên cứu so sánh giữa bề mặt được gia công và những bề mặt sử dụng HF và HCl / H 2 SO 4 (DAE) đã chỉ ra rằng bề mặt được xử lý axit có khả năng chống loại bỏ mô-men xoắn ngược cao hơn và khả năng tích hợp xương tốt hơn [ 55 ]. Để kiểm tra bề mặt được làm nhám bởi DAE, Yang et al. [ 48] đã cấy mười lăm implant vào xương chầy của thỏ. Cần lưu ý rằng các bề mặt nhám được implant cho thấy giá trị mômen xoắn lớn hơn ở 2, 4 và 8 tuần so với bề mặt được tiền xử lý. Đồng thời, phân tích mô hình học đã chứng minh rằng sự tiếp xúc giữa xương với implant tăng lên đáng kể cùng với sự hình thành xương quanh implant. Do đó, DAE có thể cung cấp một bề mặt có độ vi nhám nhất định, do đó góp phần vào quá trình tích xương nhanh chóng [ 35 ]. Tuy nhiên, việc xử lý axit ăn mòn phụ thuộc nhiều vào việc lựa chọn axit và cách thức sản xuất. Juodzbalys và cộng sự. [ 69] quan sát thấy rằng một implant titan được soi mòn axit có hình thái bề mặt tương tự như những hình thái thu được từ quá trình xử lý bề mặt được phun cát hạt lớn và soi mòn acid (SLA). Họ phát hiện ra rằng các mẫu của các chương trình titan một bề mặt nhám tốt với 1-10 μ micropits m sau khi soi mòn với H 2 SO 4 và sau đó HCl so với một microtexture bề mặt kém bởi HCl và sau đó H 2 S0 4 [ 69 ]. Một nghiên cứu so sánh cũng đã được thực hiện giữa bề mặt được gia công và bề mặt được soi mòn kép như thể hiện trong Hình 4 .

Người ta lưu ý rằng bề mặt được xử lý bằng axit cho sức đề kháng lớn hơn trong việc loại bỏ mô-men xoắn ngược và khả năng tích hợp xương tốt hơn so với các bề mặt implant tiền xử lý [ 55 ]. Xử lý bề mặt thông qua ăn mòn axit trên implant zirconia đã được báo cáo là có tác dụng tương tự đối với mật độ của implant ghép xương và khả năng tương đối để tích hợp xương [ 61 ]. Tuy nhiên, tác dụng phụ như tạo dạng xốp porosities, với các kích cỡ khác nhau, 0,5-2 μ m, cũng được hình thành do việc sử dụng các axit [ 58 , 70 ]. Quá trình này bằng cách nào đó cũng được cho là có lợi cho sự phát triển của mô và các tương tác bề mặt tế bào trong implant nha khoa [ 70]. Sự thành công của quá trình tích hợp xương hoặc neo implant được đo bằng cách sử dụng một lực quay để đảo ngược sự quay của mô-men xoắn. Khi giá trị lực quay của mô-men xoắn tăng lên, sự tiếp xúc giữa xương với implant (BIC) cũng tăng lên dẫn đến sự tích hợp xương lớn hơn [ 51 ].Sandblast, Large-Grit, and Acid Etching (SLA)
SLA được sử dụng để gây xói mòn bề mặt bằng cách bôi một loại axit mạnh lên bề mặt đã được thổi cát [ 17 ]. Phương pháp xử lý này kết hợp phun áp lực với các hạt cát sạn lớn và ăn mòn axit tuần tự để có được độ nhám vĩ mômacro (roughness) và các hố vi mô (micro pits) [ 58 ] để tăng độ nhám bề mặt cũng như khả tich hợp xương [ 71 – 74 ]. Cho và Jung [ 71 ] phát hiện ra rằng bề mặt SLA sở hữu khoang rộng (từ 5 μ m đến 20 μ m đường kính) và hố vi (từ ~ 0,5 μ m đến 3 μm đường kính ), cho thấy sự gia tăng độ nhám bề mặt và diện tích bề mặt. Do đó, bề mặt được xử lý SLA được cho là hữu ích để cải thiện sự tích hợp mô và tăng sinh tế bào. Nghiên cứu in vivo trên sáu con chó trưởng thành được thực hiện bởi Xue et al. [ 52 ] chỉ ra rằng bề mặt sau khi thổi cát và xử lý kiềm tuần tự cho thấy độ bền cắt cao, cải thiện sự phát triển xương sớm và tích hợp xương. Một số nghiên cứu gần đây về xử lý hóa học hai bước (axit-kiềm) nhận thấy rằng hình thái được tối ưu hóa và hoạt tính sinh học tốt đã dẫn đến sự tích hợp xương tốt trong giai đoạn đầu của quá trình cấy [ 75 ]. Tương tự, He et al. [ 76 ] cũng phát hiện ra rằng các implant được xử lý bằng phương thổi cát , sau đó là DAE (HCl và H2 SO 4 ) thúc đẩy quá trình tích hợp xương tốt hơn trong giai đoạn lành thương, cho thấy sự cải thiện đáng kể về hoạt tính sinh học. Ngoài ra, đánh giá sinh học của Kim et al. [ 58 ] phát hiện ra rằng các nguyên bào xương của con người phát triển tuyệt vời trên bề mặt SLA, nơi cung cấp không gian rộng hơn cho sự gắn kết và tăng sinh của tế bào. Bề mặt hình thái học cho SLA thường trở nên khó khăn và bất thường sau khi phun cát, nhưng sau đó sau khi điều trị axit soi mòn bề mặt đồng đều hơn và hố vi nhỏ (1-2 μ m đường kính) được tạo ra như thể hiện trong hình 5 (a) và 5 ( b) .

- Các phương pháp khác
Ion hóa Implant , điều trị bằng laser, phún xạ sputtering (*), và các kết hợp khác của một số kỹ thuật đã đề cập cũng được thảo luận ngắn gọn trong tổng quan này. Một implant ion hóa, ví dụ, liên quan đến tăng tốc các ion của vật liệu trong một điện trường và tác động lên bề mặt đến độ sâu khoảng 1 μ m [ 1 ]. Braceras và các đồng nghiệp của ông [ 37 ] đã sử dụng phương pháp này để khảo sát các đặc tính tích hợp liên kết của bề mặt implant được xử lý. Họ phát hiện ra rằng việc cấy ion coban vào hợp kim titan đã cải thiện đáng kể sự tích hợp xương. Lắng đọng qua lớp phủ nhúng nanocomposite (HA-ZrO 2 -Al 2 O 3) trên nền titan cho thấy cường độ bám dính cao nhất hơn so với các lớp phủ HA [ 37 ]. Một kỹ thuật khác được quan sát bởi Pető et al. [ 77 ] liên quan đến laser thủy tinh Nd, trong đó mô-men xoắn loại bỏ của implant đối với bề mặt được xử lý bằng laser lớn hơn 20% so với implant được tiền xử lý và implant thổi cát. Những kết quả này tương ứng tốt với dữ liệu được báo cáo bởi Hallgren et al. [ 75 ] người đã chứng minh rằng giá trị mô-men xoắn loại bỏ đối với implant được điều chỉnh bề mặt bằng laser (52 Ncm) lớn hơn so với implant bề mặt đã gia công (35 Ncm) sau 12 tuần lành thương. Kết quả này cũng phù hợp với các nghiên cứu khác [ 9 , 78 – 81 ]. Sử dụng phương pháp phún xạ magnetron xung [ 72 ], Bề mặt titan lắng đọng ZrO 2 -Ag và ZrO 2 – Cu đã cải thiện hiệu suất kháng khuẩn so với vật liệu cấy Ti tinh khiết [ 58 ]. Trong một nghiên cứu khác, phương pháp kết hợp giữa bề mặt được xử lý bằng laser và ăn mòn axit đã được chứng minh là có khả năng tích hợp xương tốt hơn so với bề mặt được xử lý bằng laser với giá trị BIC là 49,71% [ 80 ]. Xu hướng xử lý bề mặt Titan
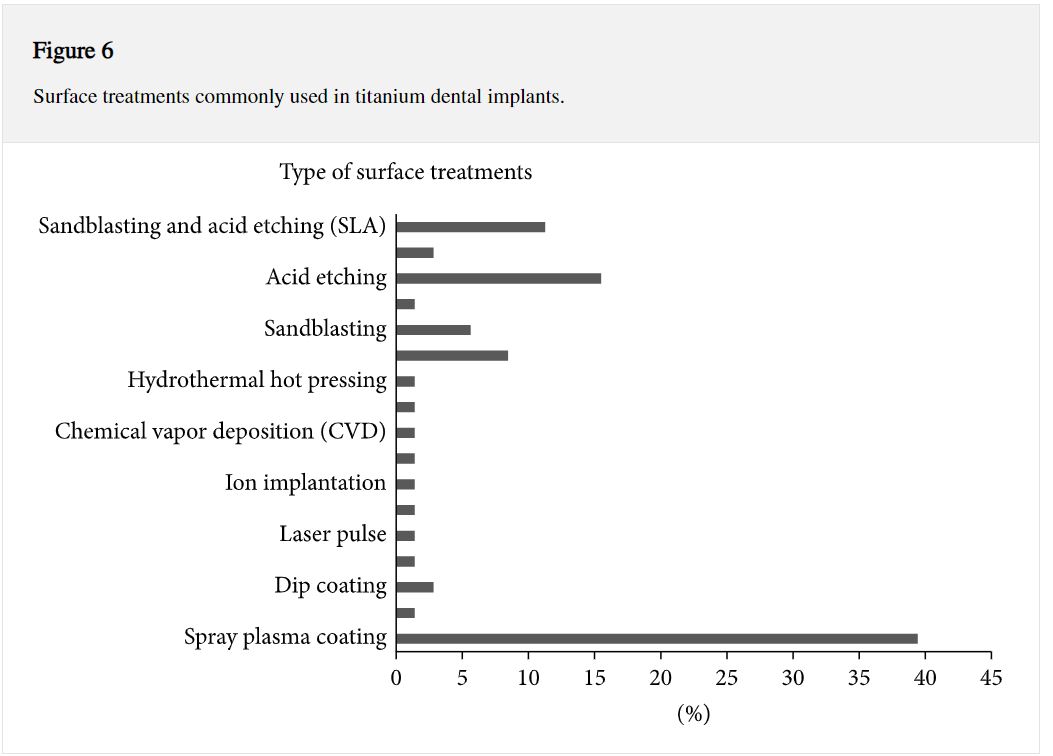
Mối quan tâm lớn nhất đã được ghi nhận trong việc sử dụng kỹ thuật phun plasma và ăn mòn axit. Rõ ràng, phương pháp phun plasma là thích hợp nhất (xem Hình 6 ) do ưu điểm của nó trong việc cung cấp bề mặt implant xốp để tiếp xúc với xương nhiều hơn [ 30 ]. Chất lượng của bề mặt lớp phủ phụ thuộc nhiều vào loại vật liệu phủ. Ngoài ra, nghiên cứu về phun plasma cho thấy các tế bào phát triển tốt trên bề mặt implant [ 9 ] và sự tiếp xúc với xương tốt giúp tăng tốc quá trình hình thành xương [ 30 ]. Tương đối, các thiết bị implant phủ như ZrO 2 có độ nhám bề mặt cao với xấp xỉ 5.7 ± 0.2μ m. Giá trị này có thể được tăng lên đến 8.68 ±0.37 μ m [ 47 ] khi ăn mòn axit được áp dụng trước khi đắp phủ. Ngay cả những soi mòn axit kép đóng một vai trò quan trọng trong việc sản xuất các bề mặt tốt, với độ nhám khác nhau, 0,44 – 3,51 μ m [ 34 , 35 , 82 ]. Nói chung, DAE tốt hơn so với soi mòn axit đơn do thành phần, số lượng và nồng độ cao. Trong trường hợp implant nha khoa, ảnh hưởng của quá trình ăn mòn axit dựa trên nồng độ và loại axit cũng như nhiệt độ và thời gian, trong đó độ nhám bề mặt thường tăng lên khi nồng độ axit tăng dần [ 67]. Hơn nữa, kỹ thuật thổi cát và SLA cũng thường được sử dụng để cải thiện độ nhám bề mặt và có tiềm năng cao để cải thiện cho giai đoạn lành thương . Mỗi kỹ thuật đơn lẻ đều có những ưu điểm và hạn chế riêng. Do đó, để đảm bảo chất lượng cao của vật liệu phủ, tầm quan trọng của việc xử lý sơ bộ bề mặt trước khi tiến hành công việc xử lýbề mặt cũng phải được xem xét.

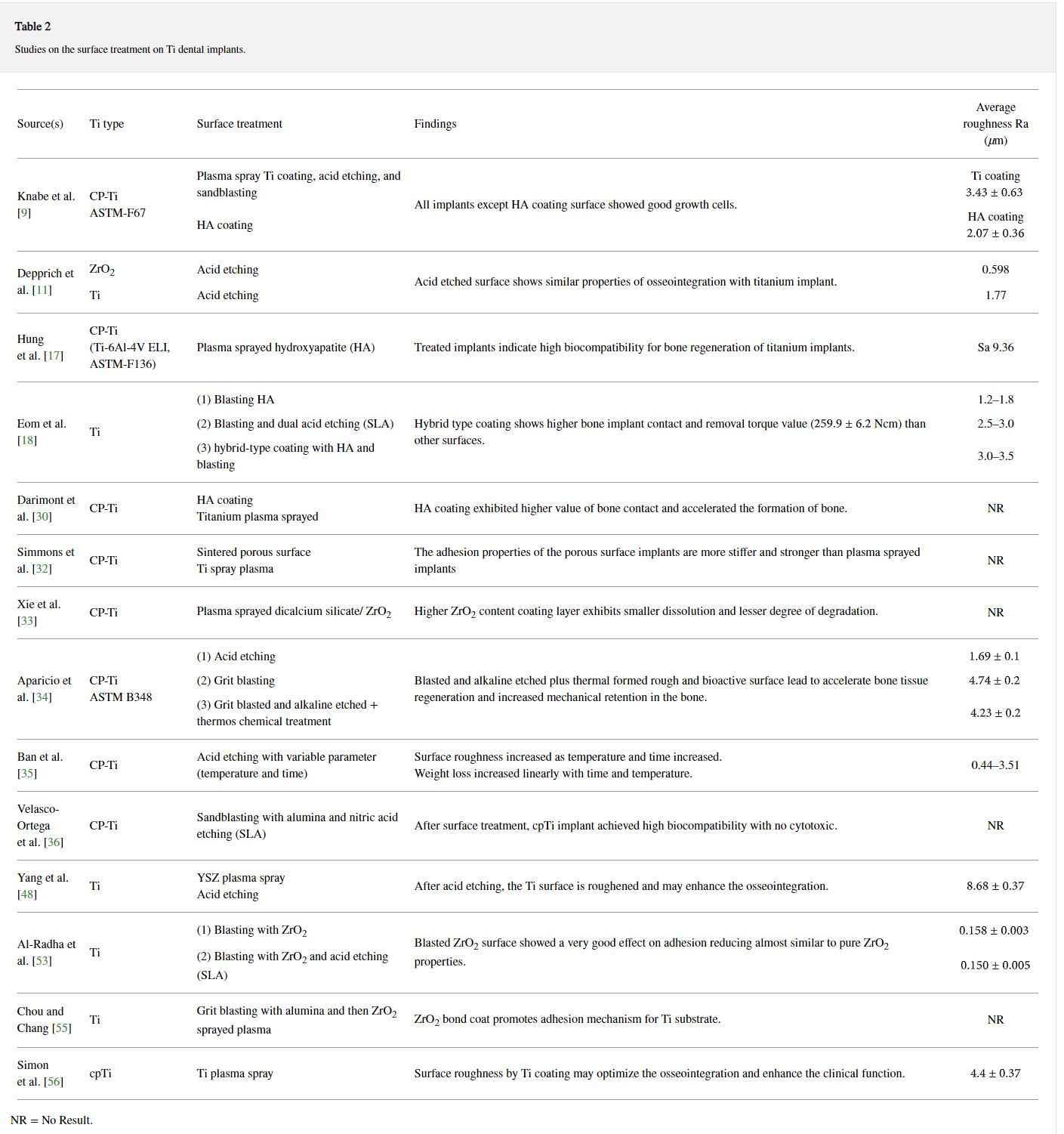
Trong bài báo này, các phương pháp quan trọng đã được sử dụng rộng rãi trong công việc xử lý bề mặt của implant răng bằng titan được tóm tắt trong Bảng 2 . Mặc dù có nhiều nghiên cứu về phương pháp phun plasma cho đến nay, nhưng các kết quả trong tài liệu cho thấy những khó khăn trong việc quyết định giá trị tối ưu của độ nhám bề mặt để tích hợp xương tốt hơn nhưng giảm độ bám dính của vi khuẩn

Nhận xét cuối cùng
Nói chung, kỹ thuật phủ đóng góp vào những tác động tích cực quan trọng của việc ứng dụng implant nha khoa. Hầu hết các tác giả [ 6 , 9 , 30 , 31 , 33 , 56 , 79 – 81 , 83 – 86 ] đồng ý rằng một kỹ thuật phủ tốt có thể có tác động cao đến tính chất cơ học của implant nha khoa. Tuy nhiên, kỹ thuật này có một số hạn chế bao gồm khả năng bám dính lâu dài của lớp phủ với vật liệu nền [ 76 ], sự không đồng đều về độ dày của lớp lắng đọng [ 84 ], và các biến thể về độ kết tinh [ 87] và thành phần của lớp phủ. Về mặt thực tế, hiểu rõ hơn về các thông số phù hợp trong quá trình phun plasma là rất quan trọng để kiểm soát những hạn chế này. Ngược lại, hầu hết các nghiên cứu không thể xác định bất kỳ ưu điểm hoặc nhược điểm chính nào với implant bề mặt thổi cát. thổi nhám là một kỹ thuật phổ biến để xử lý bề mặt có thể dễ dàng làm thô bề mặt implant nhưng không đủ để cung cấp đảm bảo cho các đặc tính quan trọng như tiếp xúc với xương – implant, giá trị mô-men xoắn loại bỏ, phản ứng mô và tính tương thích sinh học. Mặt khác, kỹ thuật implant ion hóa rất hữu ích để làm cứng bề mặt titan nhưng không thể áp dụng cho implant nha khoa [ 64]. Nó hữu ích nhất trong các thiết bị chỉnh hình có thể khớp hoặc trong các tình huống gây mòn. Một kỹ thuật xử lý bề mặt được ưa chuộng khác là DAE có thành phần, lượng và nồng độ cao [ 63 ]. Cho đến nay, lớp phủ ceramic (canxi photphat, HA và TiO 2 ) vẫn là vật liệu ceramic sinh học phổ biến nhất trong lĩnh vực xử lý bề mặt. Tuy nhiên, HA được công nhận là ứng cử viên tốt nhất trong ceramic sinh học so với TiO 2 [ 76 ]. Trong khi đó, zirconia cũng có tiềm năng tốt như implant nha khoa, nhờ đó nó thúc đẩy độ cứng vi mô cao hơn [ 33] và cơ tính tốt hơn khi phủ lên hợp kim Ti. Zirconia ổn định với các hạt yttria (YSZ) như một pha thứ cấp trong lớp phủ cũng được cho là tăng cường phân tán do sự phân bố đồng nhất của các hạt YSZ trong chất nền [ 84 ], dẫn đến liên kết tốt trong hỗn hợp, và do đó cải thiện tính chất cơ học.
Hiện nay, tạo nhám bề mặt (ví dụ: phun hạt, ăn mòn axit và SLA) và phủ (ví dụ, với CaP và HA) là các kỹ thuật thường được sử dụng trong thực tế. Cả hai phương pháp đều có những ưu điểm và nhược điểm như chúng ta đã thảo luận trong bài báo này. Nó đã được báo cáo rằng sự cải thiện của giao diện implant xương và khả năng chống thất bại cao hơn bị ảnh hưởng bởi bề mặt tạo nhám bằng axit [ 45 ]. Ngoài ra, được phun cát với bề mặt có hạt lớn (25–50 mm) và được tạo nhám bằng axit có giá trị trung bình 50–60% khi tiếp xúc với mô implant xương so với bề mặt được phun plasma titan chỉ có giá trị trung bình 30–40% là liên hệ implant xương sau 6 tuần [ 46]. Giá trị BIC rất quan trọng trong sự thành công lâu dài của implant nha khoa. Nhiều nghiên cứu đã chứng minh rằng bề mặt implant thô ráp cho thấy khả năng bám vào xương và BIC tốt hơn so với implant có bề mặt nhẵn [ 22 , 46 , 75 ]. Độ nhám bề mặt cũng kích thích sự di chuyển và tăng sinh của tế bào, do đó dẫn đến BIC tốt hơn [ 50 ]. Các phương pháp sửa đổi khác nhau đã được nghiên cứu, cụ thể là phun cát, đá mài lớn, ăn mòn axit (SLA) và các bề mặt phủ khác nhau về mặt hóa học nhưng có cùng tính chất vật lý đã được tiến hành để đánh giá BIC như một thước đo sự tích hợp xương.
Cần lưu ý rõ ràng rằng bằng cách thay đổi hoặc điều chỉnh kết cấu bề mặt, cụ thể là độ nhám của implant titan, đặc biệt, có thể đạt được các hiệu ứng mong muốn như tiếp xúc với mô implant xương, giá trị mô-men xoắn loại bỏ, phản ứng mô và tính tương thích sinh học. Do đó, hầu hết các công trình vẫn ủng hộ xử lý bề mặt của răng implant qua lớp phủ và tạo nhám bằng axit trên các phương pháp khác trong việc sản xuất các bề mặt chất nền tốt cho tích hợp xương, với độ nhám bề mặt khác nhau, 0,44-8,68 μ m. Nói tóm lại, một bề mặt tốt với độ nhám và đặc tính cơ học phù hợp có thể dẫn đến sự tích hợp xương tốt hơn để implant nha khoa thành công.
(*) Phún xạ (tiếng Anh: Sputtering) hay Phún xạ cathode (Cathode Sputtering) là kỹ thuật chế tạo màng mỏng dựa trên nguyên lý truyền động năng bằng cách dùng các ion khí hiếm được tăng tốc dưới điện trường bắn phá bề mặt vật liệu từ bia vật liệu, truyền động năng cho các nguyên tử này bay về phía đế và lắng đọng trên đế. nguồn : KIWI
- Phun phủ Plasma
References
- W. R. Lacefield, “Materials characteristics of uncoated/ceramic-coated implant materials,” Advances in Dental Research, vol. 13, pp. 21–26, 1999.View at: Publisher Site | Google Scholar
- M. Özcan and C. Hämmerle, “Titanium as a reconstruction and implant material in dentistry: advantages and pitfalls,” Materials, vol. 5, no. 9, pp. 1528–1545, 2012.View at: Publisher Site | Google Scholar
- J. I. Rosales-Leal, M. A. Rodríguez-Valverde, G. Mazzaglia et al., “Effect of roughness, wettability and morphology of engineered titanium surfaces on osteoblast-like cell adhesion,” Colloids and Surfaces A: Physicochemical and Engineering Aspects, vol. 365, no. 1–3, pp. 222–229, 2010.View at: Publisher Site | Google Scholar
- H. Nakae, M. Yoshida, and M. Yokota, “Effects of roughness pitch of surfaces on their wettability,” Journal of Materials Science, vol. 40, no. 9-10, pp. 2287–2293, 2005.View at: Publisher Site | Google Scholar
- L. Ponsonnet, K. Reybier, N. Jaffrezic et al., “Relationship between surface properties (roughness, wettability) of titanium and titanium alloys and cell behaviour,” Materials Science and Engineering C, vol. 23, no. 4, pp. 551–560, 2003.View at: Publisher Site | Google Scholar
- V. Sollazzo, F. Pezzetti, A. Scarano et al., “Zirconium oxide coating improves implant osseointegration in vivo,” Dental Materials, vol. 24, no. 3, pp. 357–361, 2008.View at: Publisher Site | Google Scholar
- N. Goyal and R. K. Priyanka, “Effect of various implant surface treatments on osseointegration—a literature review,” Indian Journal of Dental Sciences, vol. 4, pp. 154–157, 2012.View at: Google Scholar
- A. B. Novaes Jr., S. L. S. de Souza, R. R. M. de Barros, K. K. Y. Pereira, G. Iezzi, and A. Piattelli, “Influence of implant surfaces on osseointegration,” Brazilian Dental Journal, vol. 21, no. 6, pp. 471–481, 2010.View at: Google Scholar
- C. Knabe, F. Klar, R. Fitzner, R. J. Radlanski, and U. Gross, “In vitro investigation of titanium and hydroxyapatite dental implant surfaces using a rat bone marrow stromal cell culture system,” Biomaterials, vol. 23, no. 15, pp. 3235–3245, 2002.View at: Publisher Site | Google Scholar
- M. F. A. Fouda, A. Nemat, A. Gawish, and A. R. Baiuomy, “Does the coating of titanium implants by hydroxyapatite affect the elaboration of free radicals. An experimental study,” Australian Journal of Basic and Applied Sciences, vol. 3, pp. 1122–1129, 2009.View at: Google Scholar
- R. Depprich, M. Ommerborn, H. Zipprich et al., “Behavior of osteoblastic cells cultured on titanium and structured zirconia surfaces,” Head & Face Medicine, vol. 4, no. 1, article 29, 2008.View at: Publisher Site | Google Scholar
- R. M. London, F. A. Roberts, D. A. Baker, M. D. Rohrer, and R. B. O’Neal, “Histologic comparison of a thermal dual-etched implant surface to machined, TPS, and HA surfaces: bone contact in vivo in rabbits,” The International Journal of Oral & Maxillofacial Implants, vol. 17, no. 3, pp. 369–376, 2002.View at: Google Scholar
- E. A. Bonfante, C. Marin, R. Granato et al., “Histologic and biomechanical evaluation of alumina-blasted/acid-etched and resorbable blasting media surfaces,” Journal of Oral Implantology, vol. 38, no. 5, pp. 549–556, 2012.View at: Publisher Site | Google Scholar
- F. Parsikia, P. Amini, and S. Asgari, “Influence of mechanical and chemical surface treatments on the formation of bone-like structure in cpTi for endosseous dental implants,” Applied Surface Science, vol. 259, pp. 283–287, 2012.View at: Publisher Site | Google Scholar
- J. He, W. Zhou, X. Zhou et al., “The anatase phase of nanotopography titania plays an important role on osteoblast cell morphology and proliferation,” Journal of Materials Science: Materials in Medicine, vol. 19, no. 11, pp. 3465–3472, 2008.View at: Publisher Site | Google Scholar
- S. Vishnu and D. Kusum, “Advances in surface modification of dental implants from micron to nanotopography,” International Journal of Research in Dentistry, vol. 1, pp. 1–10, 2011.View at: Google Scholar
- K.-Y. Hung, S.-C. Lo, C.-S. Shih, Y.-C. Yang, H.-P. Feng, and Y.-C. Lin, “Titanium surface modified by hydroxyapatite coating for dental implants,” Surface and Coatings Technology, vol. 231, pp. 337–345, 2013.View at: Publisher Site | Google Scholar
- T.-G. Eom, G.-R. Jeon, C.-M. Jeong et al., “Experimental study of bone response to hydroxyapatite coating implants: bone-implant contact and removal torque test,” Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology, vol. 114, no. 4, pp. 411–418, 2012.View at: Publisher Site | Google Scholar
- L. Le Guéhennec, A. Soueidan, P. Layrolle, and Y. Amouriq, “Surface treatments of titanium dental implants for rapid osseointegration,” Dental Materials, vol. 23, no. 7, pp. 844–854, 2007.View at: Publisher Site | Google Scholar
- C. Y. Guo, A. T. H. Tang, and J. P. Matinlinna, “Insights into surface treatment methods of titanium dental implants,” Journal of Adhesion Science and Technology, vol. 26, no. 1–3, pp. 189–205, 2012.View at: Publisher Site | Google Scholar
- T. Kokubo, “Bioactive glass ceramics: properties and applications,” Biomaterials, vol. 12, no. 2, pp. 155–163, 1991.View at: Publisher Site | Google Scholar
- M. Ogino, F. Ohuchi, and L. L. Hench, “Compositional dependence of the formation of calcium phosphate films on bioglass,” Journal of Biomedical Materials Research, vol. 14, no. 1, pp. 55–64, 1980.View at: Publisher Site | Google Scholar
- T. Kitsugi, T. Nakamura, T. Yamamura, T. Kokubu, T. Shibuya, and M. Takagi, “SEM-EPMA observation of three types of apatite-containing glass-ceramics implanted in bone: the variance of a Ca-P-rich layer,” Journal of Biomedical Materials Research, vol. 21, no. 10, pp. 1255–1271, 1987.View at: Publisher Site | Google Scholar
- T. Kokubo, S. Ito, Z. T. Huang et al., “Ca, P-rich layer formed on high-strength bioactive glass-ceramic A-W,” Journal of Biomedical Materials Research, vol. 24, no. 3, pp. 331–343, 1990.View at: Publisher Site | Google Scholar
- S.-B. Cho, K. Nakanishi, T. Kokubo et al., “Dependence of apatite formation on silica gel on its structure: effect of heat treatment,” Journal of the American Ceramic Society, vol. 78, no. 7, pp. 1769–1774, 1995.View at: Publisher Site | Google Scholar
- T. Kokubo and H. Takadama, “How useful is SBF in predicting in vivo bone bioactivity?” Biomaterials, vol. 27, no. 15, pp. 2907–2915, 2006.View at: Publisher Site | Google Scholar
- D. L. Cochran, R. K. Schenk, A. Lussi, F. L. Higginbottom, and D. Buser, “Bone response to unloaded and loaded titanium implants with a sandblasted and acid-etched surface: a histometric study in the canine mandible,” Journal of Biomedical Materials Research, vol. 40, no. 1, pp. 1–11, 1998.View at: Google Scholar
- A. Wennerberg, C. Hallgren, C. Johansson, and S. Danelli, “A histomorphometric evaluation of screw-shaped implants each prepared with two surface roughnesses,” Clinical Oral Implants Research, vol. 9, no. 1, pp. 11–19, 1998.View at: Publisher Site | Google Scholar
- X. Liu, P. K. Chu, and C. Ding, “Surface modification of titanium, titanium alloys, and related materials for biomedical applications,” Materials Science and Engineering R: Reports, vol. 47, no. 3-4, pp. 49–121, 2004.View at: Publisher Site | Google Scholar
- G. L. Darimont, R. Cloots, E. Heinen, L. Seidel, and R. Legrand, “In vivo behaviour of hydroxyapatite coatings on titanium implants: a quantitative study in the rabbit,” Biomaterials, vol. 23, no. 12, pp. 2569–2575, 2002.View at: Publisher Site | Google Scholar
- A. Ochsenbein, F. Chai, S. Winter, M. Traisnel, J. Breme, and H. F. Hildebrand, “Osteoblast responses to different oxide coatings produced by the sol-gel process on titanium substrates,” Acta Biomaterialia, vol. 4, no. 5, pp. 1506–1517, 2008.View at: Publisher Site | Google Scholar
- C. A. Simmons, N. Valiquette, and R. M. Pilliar, “Osseointegration of sintered porous-surfaced and plasma spray-coated implants: an animal model study of early postimplantation healing response and mechanical stability,” Journal of Biomedical Materials Research, vol. 47, no. 2, pp. 127–138, 1999.View at: Publisher Site | Google Scholar
- Y. Xie, X. Liu, X. Zheng, C. Ding, and P. K. Chu, “Improved stability of plasma-sprayed dicalcium silicate/zirconia composite coating,” Thin Solid Films, vol. 515, no. 3, pp. 1214–1218, 2006.View at: Publisher Site | Google Scholar
- C. Aparicio, A. Padrós, and F.-J. Gil, “In vivo evaluation of micro-rough and bioactive titanium dental implants using histometry and pull-out tests,” Journal of the Mechanical Behavior of Biomedical Materials, vol. 4, no. 8, pp. 1672–1682, 2011.View at: Publisher Site | Google Scholar
- S. Ban, Y. Iwaya, H. Kono, and H. Sato, “Surface modification of titanium by etching in concentrated sulfuric acid,” Dental Materials, vol. 22, no. 12, pp. 1115–1120, 2006.View at: Publisher Site | Google Scholar
- E. Velasco-Ortega, A. Jos, A. M. Cameán, J. Pato-Mourelo, and J. J. Segura-Egea, “In vitro evaluation of cytotoxicity and genotoxicity of a commercial titanium alloy for dental implantology,” Mutation Research—Genetic Toxicology and Environmental Mutagenesis, vol. 702, no. 1, pp. 17–23, 2010.View at: Publisher Site | Google Scholar
- I. Braceras, J. I. Alava, J. I. Oñate et al., “Improved osseointegration in ion implantation-treated dental implants,” Surface and Coatings Technology, vol. 158-159, pp. 28–32, 2002.View at: Publisher Site | Google Scholar
- Y. W. Gu, K. A. Khor, D. Pan, and P. Cheang, “Activity of plasma sprayed yttria stabilized zirconia reinforced hydroxyapatite/Ti-6Al-4V composite coatings in simulated body fluid,” Biomaterials, vol. 25, no. 16, pp. 3177–3185, 2004.View at: Publisher Site | Google Scholar
- H. Zhou, F. Li, B. He, J. Wang, and B.-D. Sun, “Air plasma sprayed thermal barrier coatings on titanium alloy substrates,” Surface and Coatings Technology, vol. 201, no. 16-17, pp. 7360–7367, 2007.View at: Publisher Site | Google Scholar
- J.-G. Qian, H.-T. Li, P.-R. Li, and Y.-C. Chen, “Preparation of hydroxyapatite coatings by acid etching-electro deposition on pure titanium,” in Proceedings of the International Conference on Biomedical Engineering and Biotechnology (iCBEB ’12), pp. 433–436, May 2012.View at: Publisher Site | Google Scholar
- P. Y. Lim, P. L. She, and H. C. Shih, “Microstructure effect on microtopography of chemically etched α + β Ti alloys,” Applied Surface Science, vol. 253, no. 2, pp. 449–458, 2006.View at: Publisher Site | Google Scholar
- D. D. Deligianni, N. Katsala, S. Ladas, D. Sotiropoulou, J. Amedee, and Y. F. Missirlis, “Effect of surface roughness of the titanium alloy Ti-6Al-4V on human bone marrow cell response and on protein adsorption,” Biomaterials, vol. 22, no. 11, pp. 1241–1251, 2001.View at: Publisher Site | Google Scholar
- S. Ferraris, S. Spriano, G. Pan et al., “Surface modification of Ti-6Al-4V alloy for biomineralization and specific biological response: part I, inorganic modification,” Journal of Materials Science: Materials in Medicine, vol. 22, no. 3, pp. 533–545, 2011.View at: Publisher Site | Google Scholar
- R. Family, M. Solati-Hashjin, S. N. Nik, and A. Nemati, “Surface modification for titanium implants by hydroxyapatite nanocomposite,” Caspian Journal of Internal Medicine, vol. 3, no. 3, pp. 460–465, 2012.View at: Google Scholar
- P. Vanzillotta, G. A. Soares, I. N. Bastos, R. A. Simão, and N. K. Kuromoto, “Potentialities of some surface characterization techniques for the development of titanium biomedical alloys,” Materials Research, vol. 7, no. 3, pp. 437–444, 2004.View at: Publisher Site | Google Scholar
- J. L. Ong and D. C. N. Chan, “Hydroxyapatite and their use as coatings in dental implants: a review,” Critical Reviews in Biomedical Engineering, vol. 28, no. 5-6, pp. 667–707, 2000.View at: Google Scholar
- L. Fu, K. Aik Khor, and J. Peng Lim, “The evaluation of powder processing on microstructure and mechanical properties of hydroxyapatite (HA)/yttria stabilized zirconia (YSZ) composite coatings,” Surface and Coatings Technology, vol. 140, no. 3, pp. 263–268, 2001.View at: Publisher Site | Google Scholar
- G.-L. Yang, F.-M. He, X.-F. Yang, X.-X. Wang, and S.-F. Zhao, “Bone responses to titanium implants surface-roughened by sandblasted and double etched treatments in a rabbit model,” Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology, vol. 106, no. 4, pp. 516–524, 2008.View at: Publisher Site | Google Scholar
- X. Liu, R. W. Y. Poon, S. C. H. Kwok, P. K. Chu, and C. Ding, “Plasma surface modification of titanium for hard tissue replacements,” Surface and Coatings Technology, vol. 186, no. 1-2, pp. 227–233, 2004.View at: Publisher Site | Google Scholar
- E. Chang, W. J. Chang, B. C. Wang, and C. Y. Yang, “Plasma spraying of zirconia-reinforced hydroxyapatite composite coatings on titanium: Part I Phase, microstructure and bonding strength,” Journal of Materials Science: Materials in Medicine, vol. 8, no. 4, pp. 193–200, 1997.View at: Publisher Site | Google Scholar
- S.-A. Cho and K.-T. Park, “The removal torque of titanium screw inserted in rabbit tibia treated by dual acid etching,” Biomaterials, vol. 24, no. 20, pp. 3611–3617, 2003.View at: Publisher Site | Google Scholar
- W. Xue, X. Liu, X. Zheng, and C. Ding, “In vivo evaluation of plasma-sprayed titanium coating after alkali modification,” Biomaterials, vol. 26, no. 16, pp. 3029–3037, 2005.View at: Publisher Site | Google Scholar
- A. S. D. Al-Radha, D. Dymock, C. Younes, and D. O’Sullivan, “Surface properties of titanium and zirconia dental implant materials and their effect on bacterial adhesion,” Journal of Dentistry, vol. 40, no. 2, pp. 146–153, 2012.View at: Publisher Site | Google Scholar
- B. Bacchelli, G. Giavaresi, M. Franchi et al., “Influence of a zirconia sandblasting treated surface on peri-implant bone healing: an experimental study in sheep,” Acta Biomaterialia, vol. 5, no. 6, pp. 2246–2257, 2009.View at: Publisher Site | Google Scholar
- B.-Y. Chou and E. Chang, “Interface investigation of plasma-sprayed hydroxyapatite coating on titanium alloy with ZrO2 intermediate layer as bond coat,” Scripta Materialia, vol. 45, no. 4, pp. 487–493, 2001.View at: Publisher Site | Google Scholar
- M. Simon, C. Lagneau, J. Moreno, M. Lissac, F. Dalard, and B. Grosgogeat, “Corrosion resistance and biocompatibility of a new porous surface for titanium implants,” European Journal of Oral Sciences, vol. 113, no. 6, pp. 537–545, 2005.View at: Publisher Site | Google Scholar
- Y. Iwaya, M. Machigashira, K. Kanbara et al., “Surface properties and biocompatibility of acid-etched titanium,” Dental Materials Journal, vol. 27, no. 3, pp. 415–421, 2008.View at: Publisher Site | Google Scholar
- H. Kim, S.-H. Choi, J.-J. Ryu, S.-Y. Koh, J.-H. Park, and I.-S. Lee, “The biocompatibility of SLA-treated titanium implants,” Biomedical Materials, vol. 3, no. 2, p. 25011, 2008.View at: Publisher Site | Google Scholar
- A. B. Novaes Jr., V. Papalexiou, M. F. M. Grisi, S. S. L. S. Souza, M. Taba Jr., and J. K. Kajiwara, “Influence of implant microstructure on the osseointegration of immediate implants placed in periodontally infected sites,” Clinical Oral Implants Research, vol. 15, no. 1, pp. 34–43, 2004.View at: Publisher Site | Google Scholar
- V. Papalexiou, A. B. Novaes, M. F. M. Grisi, S. S. L. S. Souza, M. Taba Jr., and J. K. Kajiwara, “Influence of implant microstructure on the dynamics of bone healing around immediate implants placed into periodontally infected sites. A confocal laser scanning microscopic study,” Clinical Oral Implants Research, vol. 15, no. 1, pp. 44–53, 2004.View at: Publisher Site | Google Scholar
- J. Y. Park and J. E. Davies, “Red blood cell and platelet interactions with titanium implant surfaces,” Clinical Oral Implants Research, vol. 11, no. 6, pp. 530–539, 2000.View at: Publisher Site | Google Scholar
- M. Wong, J. Eulenberger, R. Schenk, and E. Hunziker, “Effect of surface topology on the osseointegration of implant materials in trabecular bone,” Journal of Biomedical Materials Research, vol. 29, no. 12, pp. 1567–1575, 1995.View at: Publisher Site | Google Scholar
- C. Y. Guo, J. P. Matinlinna, and A. T. H. Tang, “Effects of surface charges on dental implants: past, present, and future,” International Journal of Biomaterials, vol. 2012, Article ID 381535, 5 pages, 2012.View at: Publisher Site | Google Scholar
- T. R. Rautray, R. Narayanan, and K.-H. Kim, “Ion implantation of titanium based biomaterials,” Progress in Materials Science, vol. 56, no. 8, pp. 1137–1177, 2011.View at: Publisher Site | Google Scholar
- K. Suzuki, K. Aoki, and K. Ohya, “Effects of surface roughness of titanium implants on bone remodeling activity of femur in rabbits,” Bone, vol. 21, no. 6, pp. 507–514, 1997.View at: Publisher Site | Google Scholar
- R. K. Alla, K. Ginjupalli, N. Upadhya, M. Shammas, R. Krishna Ravi, and R. Sekhar, “Surface roughness of implants: a review,” Trends in Biomaterials and Artificial Organs, vol. 25, no. 3, pp. 112–118, 2011.View at: Google Scholar
- A. S. Santiago, E. A. dos Santos, M. S. Sader, M. F. Santiago, and G. de Almeida Soares, “Response of osteoblastic cells to titanium submitted to three different surface treatments,” Brazilian Oral Research, vol. 19, no. 3, pp. 203–208, 2005.View at: Publisher Site | Google Scholar
- M. Takeuchi, Y. Abe, Y. Yoshida, Y. Nakayama, M. Okazaki, and Y. Akagawa, “Acid pretreatment of titanium implants,” Biomaterials, vol. 24, no. 10, pp. 1821–1827, 2003.View at: Publisher Site | Google Scholar
- G. Juodzbalys, M. Sapragoniene, and A. Wennerberg, “New acid etched titanium dental implant surface,” Stomatologija—Baltic Dental and Maxillofacial Journal, vol. 5, pp. 101–105, 2003.View at: Google Scholar
- C. Massaro, P. Rotolo, F. De Riccardis et al., “Comparative investigation of the surface properties of commercial titanium dental implants. Part I: chemical composition,” Journal of Materials Science: Materials in Medicine, vol. 13, no. 6, pp. 535–548, 2002.View at: Publisher Site | Google Scholar
- S.-A. Cho and S.-K. Jung, “A removal torque of the laser-treated titanium implants in rabbit tibia,” Biomaterials, vol. 24, no. 26, pp. 4859–4863, 2003.View at: Publisher Site | Google Scholar
- E. Conforto, B.-O. Aronsson, A. Salito, C. Crestou, and D. Caillard, “Rough surfaces of titanium and titanium alloys for implants and prostheses,” Materials Science and Engineering: C, vol. 24, no. 5, pp. 611–618, 2004.View at: Publisher Site | Google Scholar
- T. Monetta and F. Bellucci, “The effect of sand-blasting and hydrofluoric acid etching on Ti CP 2 and Ti CP 4 surface topography,” Open Journal of Regenerative Medicine, vol. 1, no. 3, pp. 41–50, 2012.View at: Publisher Site | Google Scholar
- O. Zinger, K. Anselme, A. Denzer et al., “Time-dependent morphology and adhesion of osteoblastic cells on titanium model surfaces featuring scale-resolved topography,” Biomaterials, vol. 25, no. 14, pp. 2695–2711, 2004.View at: Publisher Site | Google Scholar
- C. Hallgren, H. Reimers, D. Chakarov, J. Gold, and A. Wennerberg, “An in vivo study of bone response to implants topographically modified by laser micromachining,” Biomaterials, vol. 24, no. 5, pp. 701–710, 2003.View at: Publisher Site | Google Scholar
- F. M. He, G. L. Yang, Y. N. Li, X. X. Wang, and S. F. Zhao, “Early bone response to sandblasted, dual acid-etched and H2O2/HCl treated titanium implants: an experimental study in the rabbit,” International Journal of Oral & Maxillofacial Surgery, vol. 38, no. 6, pp. 677–681, 2009.View at: Publisher Site | Google Scholar
- G. Pető, A. Karacs, Z. Pászti, L. Guczi, T. Divinyi, and A. Joób, “Surface treatment of screw shaped titanium dental implants by high intensity laser pulses,” Applied Surface Science, vol. 186, no. 1–4, pp. 7–13, 2002.View at: Publisher Site | Google Scholar
- H.-L. Huang, Y.-Y. Chang, J.-C. Weng, Y.-C. Chen, C.-H. Lai, and T.-M. Shieh, “Anti-bacterial performance of Zirconia coatings on Titanium implants,” Thin Solid Films, vol. 528, pp. 151–156, 2013.View at: Publisher Site | Google Scholar
- A. Joób-Fancsaly, T. Divinyi, A. Fazekas, G. Petó, and A. Karacs, “Surface treatment of dental implants with high-energy laser beam,” Fogorvosi Szemle, vol. 93, no. 6, pp. 169–180, 2000.View at: Google Scholar
- M. Rong, L. Zhou, Z. Gou, A. Zhu, and D. Zhou, “The early osseointegration of the laser-treated and acid-etched dental implants surface: an experimental study in rabbits,” Journal of Materials Science: Materials in Medicine, vol. 20, no. 8, pp. 1721–1728, 2009.View at: Publisher Site | Google Scholar
- Y. T. Zhao, Z. Zhang, Q. X. Dai, D. Y. Lin, and S. M. Li, “Microstructure and bond strength of HA(+ZrO2+Y2O3)/Ti6Al4V composite coatings fabricated by RF magnetron sputtering,” Surface and Coatings Technology, vol. 200, no. 18-19, pp. 5354–5363, 2006.View at: Publisher Site | Google Scholar
- M. Gahlert, S. Röhling, M. Wieland, C. M. Sprecher, H. Kniha, and S. Milz, “Osseointegration of zirconia and titanium dental implants: a histological and histomorphometrical study in the maxilla of pigs,” Clinical Oral Implants Research, vol. 20, no. 11, pp. 1247–1253, 2009.View at: Publisher Site | Google Scholar
- C. Aparicio, D. Rodriguez, and F. J. Gil, “Variation of roughness and adhesion strength of deposited apatite layers on titanium dental implants,” Materials Science and Engineering C, vol. 31, no. 2, pp. 320–324, 2011.View at: Publisher Site | Google Scholar
- I. Dion, L. Bordenave, F. Lefebvre et al., “Physico-chemistry and cytotoxicity of ceramics,” Journal of Materials Science: Materials in Medicine, vol. 5, no. 1, pp. 18–24, 1994.View at: Publisher Site | Google Scholar
- H. Li, Z.-X. Li, H. Li, Y.-Z. Wu, and Q. Wei, “Characterization of plasma sprayed hydroxyapatite/ZrO2 graded coating,” Materials and Design, vol. 30, no. 9, pp. 3920–3924, 2009.View at: Publisher Site | Google Scholar
- E. S. Thian, J. Huang, Z. H. Barber, S. M. Best, and W. Bonfield, “Surface modification of magnetron-sputtered hydroxyapatite thin films via silicon substitution for orthopaedic and dental applications,” Surface and Coatings Technology, vol. 205, no. 11, pp. 3472–3477, 2011.View at: Publisher Site | Google Scholar
- C.-Y. Yang, T.-M. Lee, Y.-Z. Lu et al., “The influence of plasma-spraying parameters on the characteristics of fluorapatite coatings,” Journal of Medical and Biological Engineering, vol. 30, no. 2, pp. 91–98, 2010.View at: Google Scholar
Tác giả : A. Jemat,1 M. J. Ghazali,1 M. Razali,2 and Y. Otsuka3
Copyright : https://www.hindawi.com/journals/bmri/2015/791725/
Copyright © 2015 A. Jemat et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.