Tái tạo xương có hướng dẫn (GBR) là kỹ thuật phổ biến nhất trong nha khoa cấy ghép để điều trị các khiếm khuyết về xương và một thành phần quan trọng của quy trình GBR là sử dụng màng ngăn (Màng xương). Ngày nay, có nhiều vật liệu màng khác nhau để bác sĩ lâm sàng cấy ghép sử dụng tùy thuộc vào tình trạng lâm sàng. Tuy nhiên, thường có thể khiến bạn choáng ngợp và bối rối khi quyết định loại màng nào là lý tưởng để sử dụng. Do đó, bài viết này sẽ cung cấp và đánh giá về các màng khác nhau hiện có và thảo luận về các chỉ định sử dụng trong các tình huống lâm sàng khác nhau.
Tại sao phải vào màng xương ?
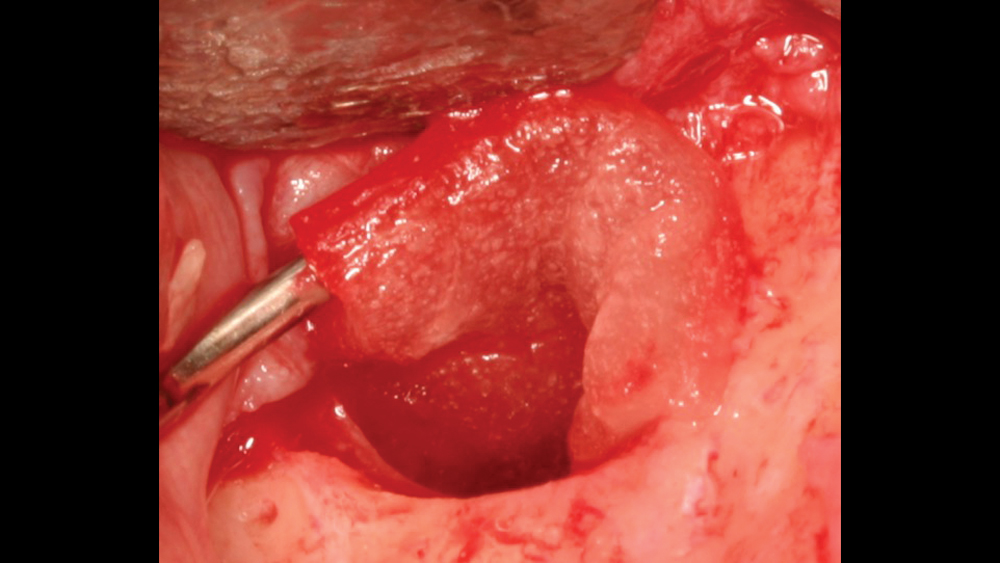
Nói chung, màng xương được sử dụng trong các quy trình GBR với mục đích như một hàng rào sinh học và cơ học chống lại sự xâm nhập của các tế bào không tham gia vào quá trình hình thành xương, ở đây chính là các tế bào biểu mô phát triển và di cư nhanh hơn làm ngăn cản các tế bào tạo xương di cư chậm hơn vào các vị trí khiếm khuyết cần tái tạo xương . 1 Khi phẫu thuật gép xương kết thúc, có sự cạnh tranh giữa các tế bào mô mềm và tái tạo xương để xâm nhập vào vị trí phẫu thuật. Nhìn chung, các tế bào mô mềm di chuyển với tốc độ nhanh hơn nhiều so với các tế bào tạo xương. Do đó, mục tiêu chính của màng ngăn là cho phép tái tạo tế bào có chọn lọc và hướng dẫn sự tăng sinh của các mô khác nhau trong quá trình lành thương . 2 Bên dưới màng, quá trình tái tạo xảy ra, bao gồm sự hình thành mạch máu và sự di chuyển của các tế bào tạo xương. Cục máu đông ban đầu được thay thế bằng xương lá (woven bone) sau quá trình hình thành mạch máu, sau đó được biến đổi thành xương phiến (lamellar bone) chịu lực. 3 Nếu màng ngăn không được sử dụng, thiếu sự duy trì không gian sẽ dẫn đến sự tích hợp mô mềm và sự phát triển của xương phục hồi sẽ không đạt được như kích thước và khối lượng mong muốn.
Đặc tính lý tưởng mong muốn của vật liệu làm màng xương là gì ?
Màng được sử dụng trong kỹ thuật GBR có thể được chia thành hai loại:
- Không tiêu: Màng không tiêu có đặc tính trơ sinh học và cần phải tiến hành phẫu thuật lần thứ hai để loại bỏ sau khi quá trình tái tạo xương hoàn tất
- Màng xương tự tiêu: Có thể tự phân hủy sinh học tự nhiên và có tỷ lệ tái hấp thụ khác nhau.
Tuy nhiên, cho dù là màng không tiêu hay tự tiêu thì tất cả các màng đều khác nhau về đặc điểm vật liệu sinh học và vật lý của chúng, và mỗi loại đều có những ưu điểm và nhược điểm sử dụng trong các tình huống lâm sàng khác nhau. Để xác định vật liệu màng sẽ sử dụng, hãy xem xét rằng màng lý tưởng phải có các đặc điểm sau:Tính tương thích của mô: Màng phải tương hợp sinh học, không gây viêm hoặc phản ứng giữa màng và mô chủ thể, để tránh vết thương bị biến dạng hoặc nhiễm trùng.
Duy trì không gian: Màng phải có khả năng duy trì không gian để cho phép quá trình tái tạo xương. Độ cứng của màng thích hợp là điều tối quan trọng để duy trì không gian và ngăn ngừa sự sụp vào vùng khuyết xương (Hình 1) .
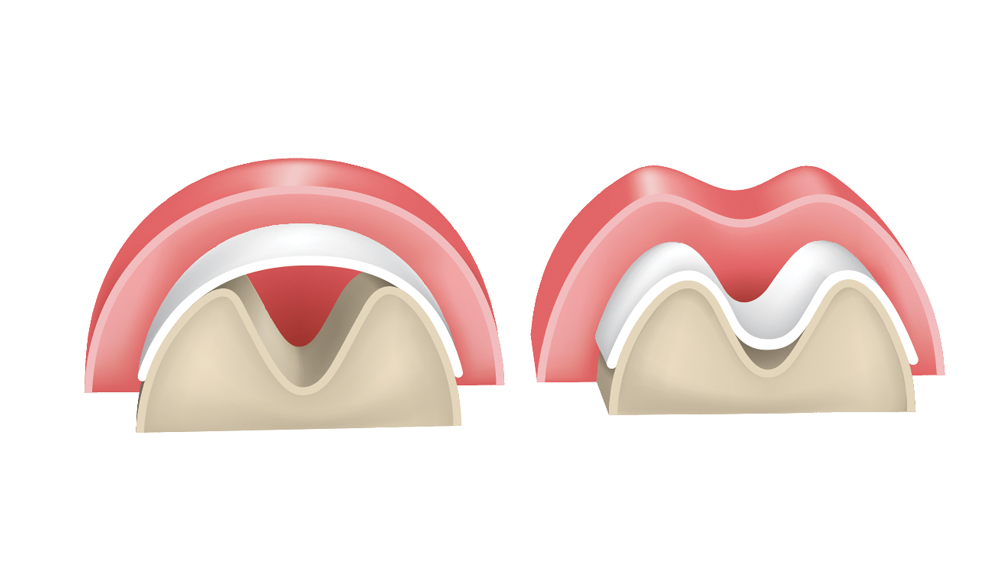
- Ổn định cục máu đông – Màng phải cung cấp sự ổn định của cục máu đông, cho phép quá trình tái tạo tiến triển và giảm sự tích hợp mô liên kết vào khiếm khuyết.
- Tính kín của tế bào: Bề mặt của màng ngăn không cho mô sợi xâm nhập vào vị trí ghép, liên quan trực tiếp với độ xốp của màng. Kích thước lỗ trên màng ngăn lớn sẽ gây có thể ức chế quá trình hình thành xương do các tế bào biểu mô phát triển xâm lấn vào. Khi kích thước lỗ trên màng nhăn quá nhỏ, sự di chuyển của tế bào bị hạn chế đối với sự lắng đọng collagen và kết quả là hình thành mô vô mạch.
- Độ bền cơ học – Màng phải có độ bền và độ bền cơ học cao để bảo vệ cục máu đông và chống lại sự xâm nhập của các tế bào và vi khuẩn không mong muốn.
- Thời gian tự tiêu của màng được dự đoán trước – Thời gian tự tiêu của màng phải trùng với tốc độ tái tạo của mô xương, điều này phụ thuộc vào vị trí của mảnh ghép, tính chất mạch máu và số lượng vật liệu ghép.
- Dễ dàng tạo hình và thao tác – Màng phải có khả năng thay đổi kích thước và hình dạng trong khi vẫn duy trì độ cứng thích hợp để ngăn ngừa sự sụp đổ của vị trí ghép.
Các loại màng xương
- Màng không tiêu:
Màng không tiêu thể hiện khả năng tương thích sinh học tuyệt vời, độ bền cơ học vượt trội và tăng độ cứng, và nhìn chung đạt được khả năng duy trì không gian thuận lợi hơn màng tự tiêu. Tuy nhiên, hiện tượng lộ màng hở qua vết thương phổ biến hơn so với màng tự tiêu và các màng này có nhược điểm là cần phải phẫu thuật lần thứ hai, dẫn đến tăng nguy cơ nhiễm trùng, chi phí và sự khó chịu của bệnh nhân. Các loại màng không thể hấp thụ phổ biến nhất bao gồm polytetrafluoroethylene (PTFE) và lưới titan.Màng PTFE
Màng PTFE mở rộng – Màng PTFE mở rộng (e-PTFE) là loại màng đầu tiên được sử dụng trong nha khoa cấy ghép và là tiêu chuẩn vàng để tái tạo xương trong những năm 1990. Màng e-PTFE có ưu điểm là nó ngăn cản các nguyên bào sợi và tế bào mô liên kết xâm nhập vào chỗ khuyết xương, đồng thời cho phép các tế bào tạo xương tái tạo lại vùng ghép. Màng e-PTFE phổ biến nhất trong nha khoa cấy ghép là GORE-TEX ® (WL Gore & Associates, Inc; Flagstaff, Ariz.).Hai mặt của màng e-PTFE có các đặc điểm khác nhau: một mặt dày khoảng 1 mm với độ xốp 90%, cản trở sự phát triển của biểu mô; và mặt còn lại dày khoảng 0,15 mm với độ xốp 30%, cung cấp không gian cho sự phát triển xương mới và ngăn chặn sự phát triển của mô sợi. 4 Màng e-PTFE có tỷ lệ tiếp xúc cao, do đó làm tăng tỷ lệ nhiễm trùng do vi khuẩn xâm nhập vào cấu trúc xốp cao. Ngoài ra, cấu trúc xốp, với kích thước lỗ khoảng 5–20 micromet, cho phép mô mềm phát triển, dẫn đến khó loại bỏ hơn. khuyết điểm lớn của màng e-PTFE là sự lộ màng trong giai đoạn lành thương và cuối cùng dẫn đến sự tạo khúm vi khuẩn do màng e-PTFE không có khả năng ngăn cản sự xâm nhập của vi khuẩn xuyên qua màng bị lộ; và cần phải có phẫu thuật thứ hai để lấy bỏ màng. Việc lộ màng sớm liên quan đến tình trạng nhiễm khuẩn vùng ghép, gây ảnh hưởng đến lành thương ổ răng và ảnh hưởng đến thể tích xương sau lành thương.
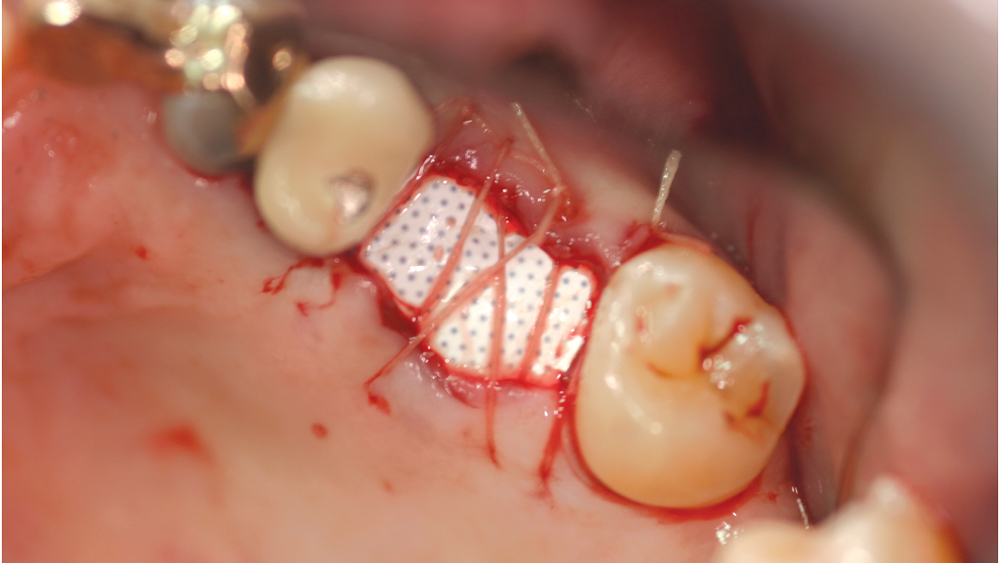
Trong thực hành lâm sàng, việc sử dụng màng tự tiêu hoặc màng e-PTFE theo nguyên tắc tái tạo xương có hướng dẫn GBR đòi hỏi vùng ghép phải được bao phủ hoàn toàn bởi mô mềm. Để đạt được điều này cần có các đường rạch giảm căng theo chiều đứng, rạch màng xương và lật vạt dày toàn phần kết hợp bán phần để đóng kín vết thương thì đầu. Hậu quả là mất độ sâu hành lang, mất nướu dính, mất nướu sừng hoá và gai nướu do phần nướu sừng hoá và nướu dính bị kéo chuyển về phía mặt trong khi đóng kín vùng ghép. Điều này gây ảnh hưởng rất lớn đến việc duy trì sự lành mạnh của mô mềm quanh phục hình implant do sự mất mô nướu sừng hoá quanh phục hình là mô có sức đề kháng tốt với các ảnh hưởng cơ học và sự xâm nhập của vi khuẩn vào vùng rãnh nướu- Màng PTFE mật độ cao – Do các biến chứng liên quan của màng e-PTFE, một vật liệu có mật độ cao hơn – nhỏ hơn 0,3 micron – đã được phát triển vào đầu những năm 1990 dưới tên Cytoplast ™ (Osteogenics Biomedical; Lubbock, Texas). PTFE mật độ cao này (còn được gọi là PTFE đậm đặc hoặc d-PTFE) đã được chứng minh là có nguy cơ vi khuẩn xâm nhập thấp hơn so với màng e-PTFE, do đó dẫn đến ít nhiễm trùng hơn. Các màng này có ưu điểm là chúng không yêu cầu đóng mô mềm vì mật độ cao và kích thước lỗ nhỏ (Hình 2) . Màng ngăn vi khuẩn đi qua đồng thời cho phép oxy khuếch tán và đi qua các phân tử nhỏ. Do không có sự phát triển của mô, màng d-PTFE dễ dàng loại bỏ hơn nhiều.

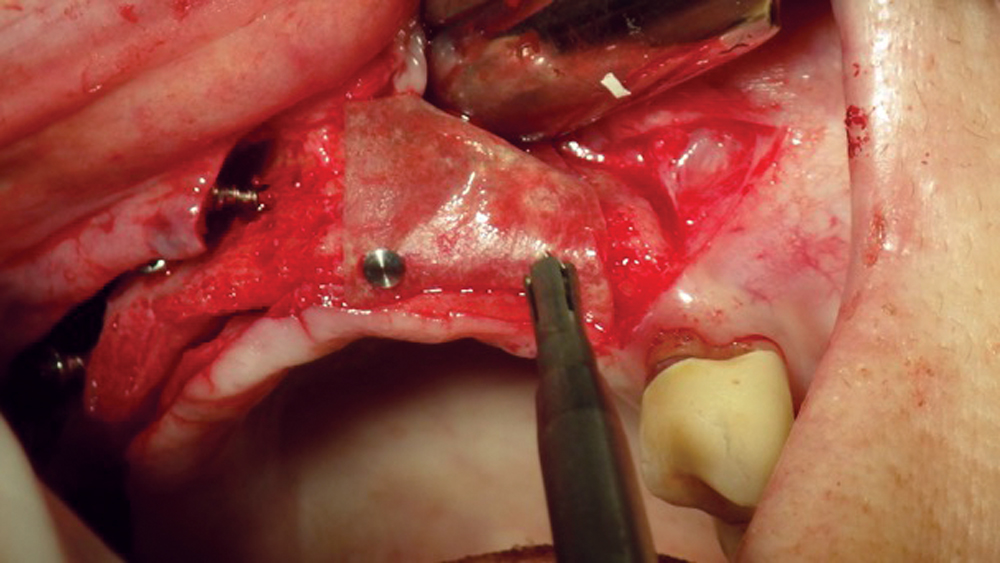
- Màng PTFE được gia cố bằng titan – Để tăng độ cứng của màng e-PTFE và d-PTFE, titan đã được thêm vào màng PTFE. Do độ cứng cấu trúc tăng lên, các màng này dễ sửa đổi hơn để phù hợp với khuyết hổng. Các loại màng này đặc biệt hữu ích trong việc xử lý các khuyết hổng dạng keo lớn (Hình 3) .

 b. Màng lưới titan
b. Màng lưới titan
- Màng PTFE được gia cố bằng titan – Để tăng độ cứng của màng e-PTFE và d-PTFE, titan đã được thêm vào màng PTFE. Do độ cứng cấu trúc tăng lên, các màng này dễ sửa đổi hơn để phù hợp với khuyết hổng. Các loại màng này đặc biệt hữu ích trong việc xử lý các khuyết hổng dạng keo lớn (Hình 3) .
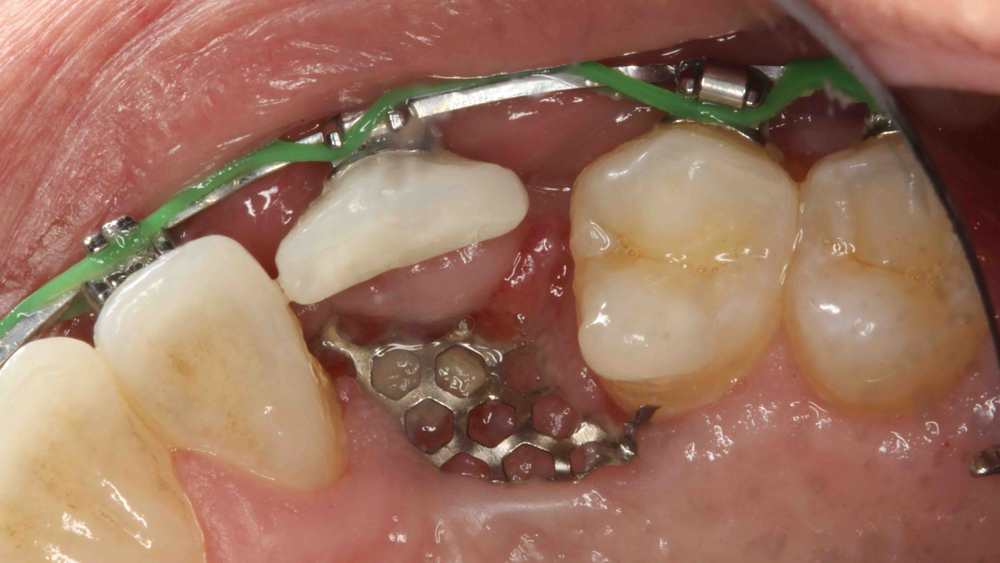
Lưới titan là một màng không ttiêu đã được chứng minh là có hiệu quả trong việc duy trì không gian mà không bị sụp đổ. Màng mềm dẻo, có thể uốn cong và thao tác để hình thành xung quanh khuyết tật xương. Lưới titan đã chứng minh tính tương thích sinh học và có các lỗ trong lưới, cho phép duy trì nguồn cung cấp máu từ màng xương. Nhược điểm của lưới titan là làm tăng nguy cơ hở của vết thương và khó duy trì độ bao phủ của mô mềm (Hình 4a, 4b) . Điều này có thể dẫn đến tăng nhiễm trùng và làm bệnh nhân khó chịu, dẫn đến việc phải tháo bỏ sớm.

2. Màng tự tiêu
- Màng tự tiêu thể hiện ưu điểm là không cần phẫu thuật giai đoạn hai để tháo bỏ, do đó làm giảm sự khó chịu và nguy cơ nhiễm khuẩn cho bệnh nhân. Tuy nhiên, mặt hạn chế của màng collagen bao gồm thời gian tái hấp thu không thể đoán trước, có thể ảnh hưởng xấu đến thể tích cần tái tạo. Màng tự tiêu thường có nguồn gốc từ collagen xenogeneic để sử dụng trong quy trình GBR là loại màng phổ biến nhất được sử dụng trong nha khoa cấy ghép ngày nay. Các loại màng tự tiêu này được chế tạo từ các vật liệu khác nhau bao gồm collagen, màng ngoài tim, fibrin giàu tiểu cầu và khung da không tế bào
a. Màng collagen:
Màng collagen có thể hấp thụ bao gồm collagen týp I hoặc túy III từ nguồn gốc bò hoặc lợn. Màng collagen dễ thao tác và có tác dụng thuận lợi trong quá trình đông máu và chữa lành vết thương, liên kết ngang thay đổi, tính kháng nguyên thấp và độ bền kéo cao. 5 Ngoài ra, chúng ức chế các tế bào biểu mô, thúc đẩy sự gắn kết của các tế bào mô liên kết và tăng kết tập tiểu cầu, dẫn đến ổn định vết thương và tăng khả năng chữa lành.
Collagen chiếm hơn 50% protein trong cơ thể con người. Khi màng collagen bị phân hủy thông qua các phản ứng enzym, quá trình này diễn ra giống như chu trình bình thường của mô. 6 Ngày nay, hầu hết các màng collagen có nguồn gốc đồng loại (allogenic) hoặc dị loại (xenogeneic) , đã trở nên phổ biến trong cấy ghép nha khoa . 7 Chúng hoạt động như giàn giáo cho quá trình tạo xương, tăng kết tập tiểu cầu và ổn định cục máu đông, và cho phép thu hút các nguyên bào sợi để giúp lành thương. Màng 8,9 Collagen được sản xuất với thời gian tự tiêu là khác nhau, quá trình tự tiêu xảy ra thông qua sự phân hủy sinh học tế bào viêm. Tỷ lệ tự tiêu được nhà sản xuất thay đổi số lượng liên kết ngang. 10Các màng collagen có sẵn ở nhiều dạng khác nhau:
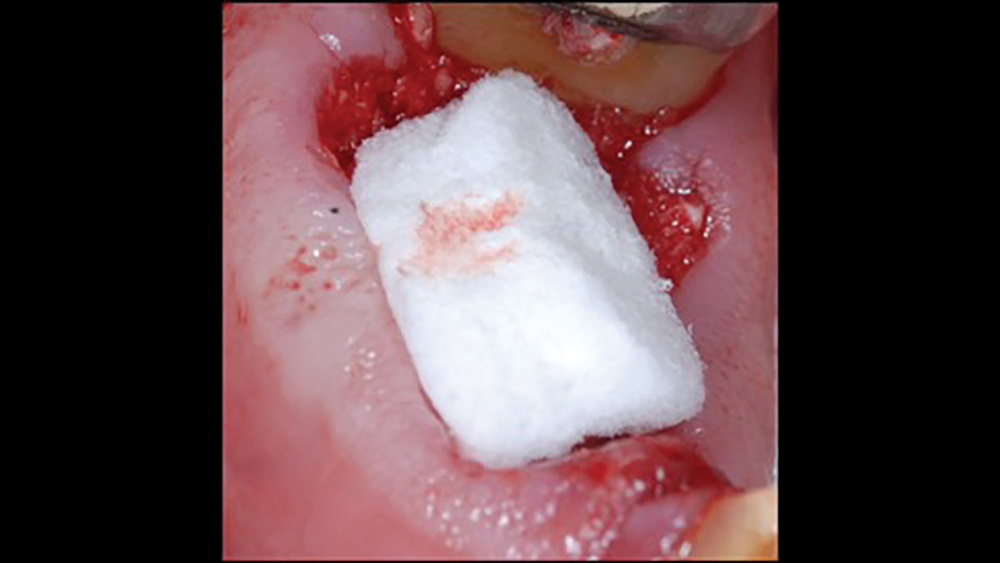
- Các khối collagen chủ yếu được sử dụng để kiểm soát chảy máu và duy trì cục máu đông trong các vị trí ổ răng sau nhổ (Hình 5a, 5b) . Các khối collagen thường là một vật liệu mềm, dẻo, giống như bọt biển, hút máu nhanh chóng, từ đó tạo ra cục máu đông nhân tạo. Collagen cho phép tập hợp các tiểu cầu, và giải phóng các yếu tố phát triển xương. các khối Collagen có thời gian tái hấp thu khoảng 10–14 ngày.
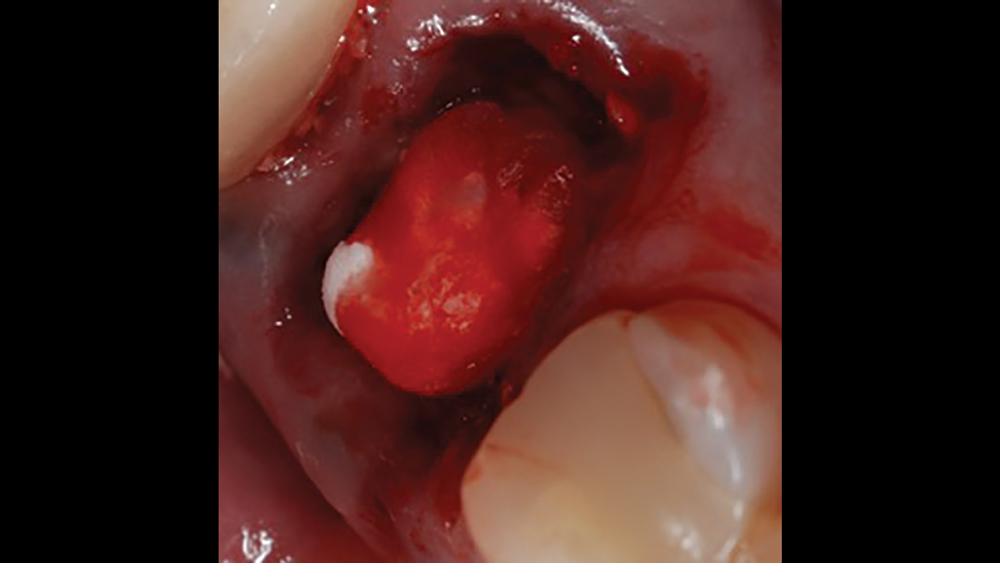
- Tape collagen là một loại collagen mỏng, dẻo được sử dụng để cầm máu và các vị trí ghép nhỏ (Hình 6a, 6b) . Ngoài ra,màng collagen được sử dụng cho các thủ thuật ghép xoang như kỹ thuật ghép lớp đầu tiên.


- Màng collagen thông thường (Regular collagen) sẽ tự tiêu trong ba đến bốn tháng và chủ yếu được sử dụng để tái tạo xương có hướng dẫn cho các khuyết hổng xương có kích thước nhỏ đến trung bình (Hình 7a, 7b) . Tốt nhất, đóng vạt kín để giảm tỷ lệ trôi xương ghép.


- Màng collagen mở rộng (Extended collagen)hấp thụ lại trong vòng bốn đến sáu tháng và được sử dụng cho các khuyết tật xương lớn hơn đòi hỏi thời gian chữa lành lâu hơn (Hình 8a, 8b) . Các màng này được sửa đổi bằng cách tăng mật độ liên kết ngang. Tuy nhiên, màng collagen hoạt động lâu hơn đã được chứng minh là có phản ứng mô chủ lớn hơn, làm suy giảm quá trình mạch máu và thoái hóa mô. 11


- Mặc dù màng collagen có nhiều ưu điểm nhưng chúng đã được chứng minh là có vấn đề nếu tiếp xúc với môi trường miệng. Khi màng collagen tiếp xúc với môi trường miệng có thể dẫn đến sự phát triển của vi khuẩn và sự di chuyển của nguyên bào sợi, dẫn đến tăng tỷ lệ thất bại vị trí ghép. Ngoài ra, có thể dẫn đến sự sụp của màng, làm ảnh hưởng đến chất lượng duy trì không gian của màng.
b. Màng ngoài tim:
Màng ngoài tim phổ biến nhất có nguồn gốc từ bò hoặc lợn, với bò có hàm lượng collagen lớn hơn (Hình 9) . Chúng thường bao gồm ba lớp với collagen và sợi đàn hồi trong một ma trận vô định hình. Bề mặt của chúng là xốp, cho phép gắn kết và tăng sinh tế bào, nhưng có mật độ gia tăng để loại trừ mô mềm xâm nhập. Màng ngoài tim có thời gian tự tiêu kéo dài hơn so với màng collagen.
c. Fibrin giàu tiểu cầu
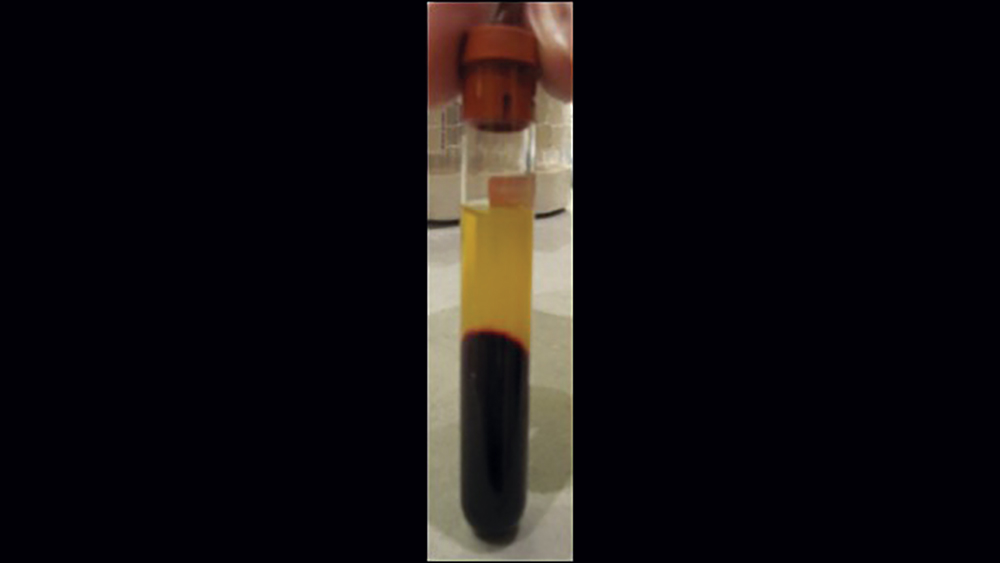
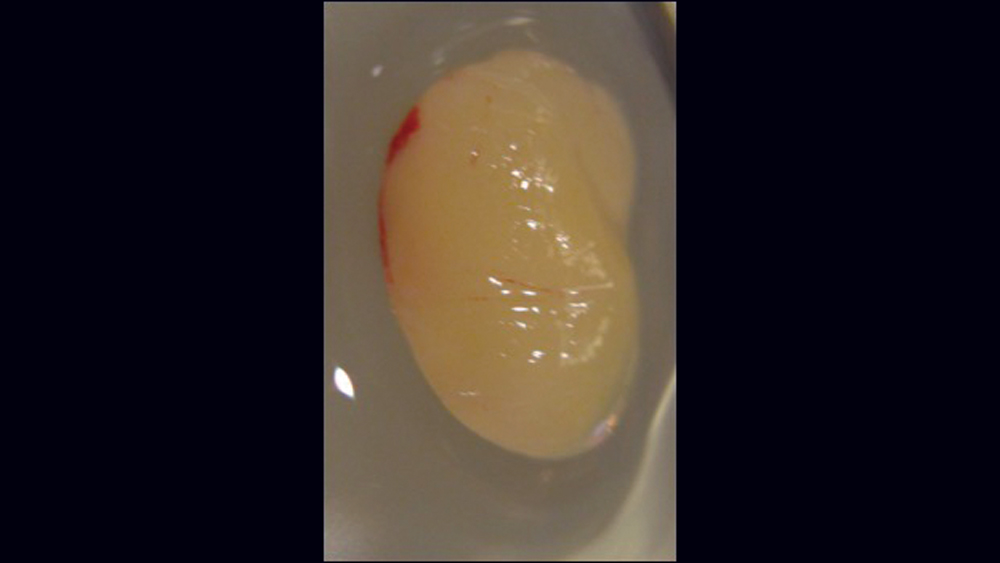
Việc sử dụng fibrin giàu tiểu cầu (PRF) ngày càng phổ biến cho các thủ thuật GBR (Hình 10a – 10d) . Cô đặc tiểu cầu thế hệ thứ hai này có ưu điểm là giá thành thấp hơn, không cần thêm chất phản ứng và nồng độ tiểu cầu cao hơn so với huyết tương giàu tiểu cầu. Quy trình PRF liên quan đến việc ly tâm toàn bộ máu của bệnh nhân, dẫn đến sự hình thành ba lớp. Lớp dưới cùng chứa các tế bào hồng cầu, được loại bỏ; lớp trên cùng có màu trong và được gọi là huyết tương nghèo tiểu cầu; và lớp giữa, là chất nền fibrin, được sử dụng như một lớp màng trong các quy trình tái tạo xương.
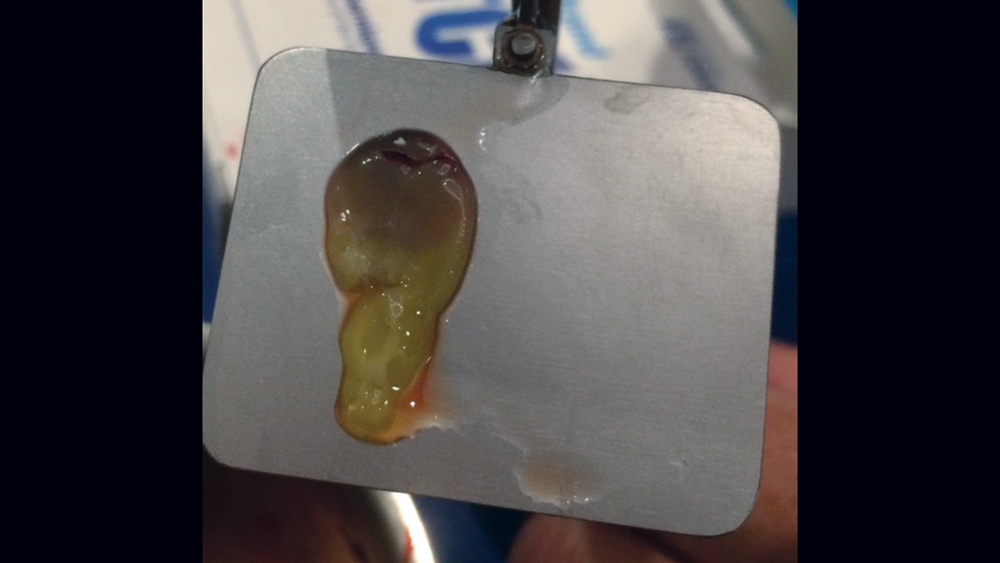
d. Khung da không tế bào (Acellular Dermal Matrix)
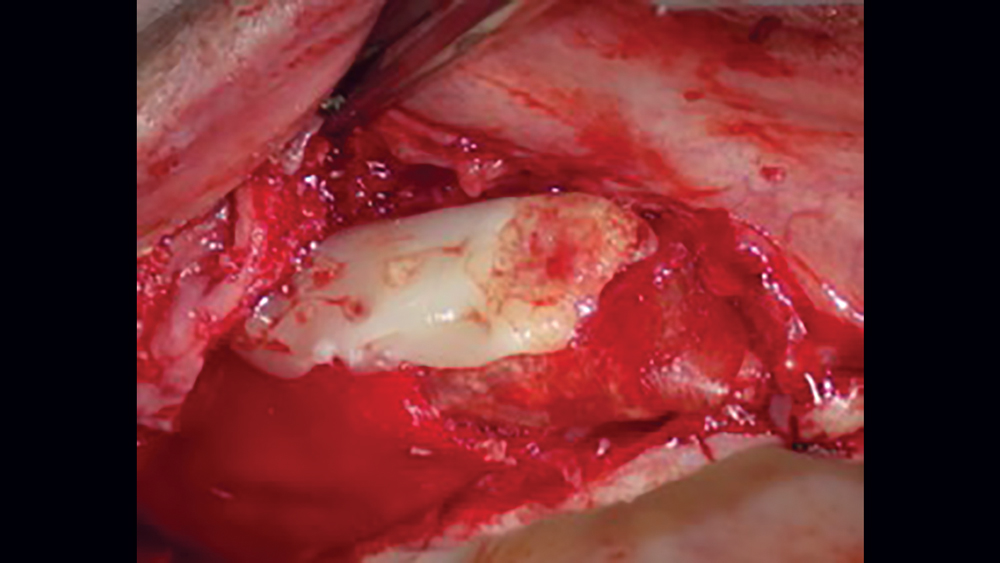
Khung da không tế bào (ADM) là một ma trận mô liên kết ở người (allograft) tương thích sinh học có nguồn gốc từ quá trình loại bỏ tất cả các tế bào bên trong lớp hạ bì. Do các tế bào được loại bỏ trong quá trình sản xuất nên không có vi rút nào có thể lây truyền. Ngoài ra, do tính chất tế bào của màng này, không có phản ứng viêm hoặc đào thải nào xảy ra. Allograft trơ, khi được sử dụng như một màng ngăn, hoạt động như một khung kiến trúc cho phép di chuyển nguyên bào sợi và quá trình mạch hóa (Hình 11a, 11b) .
Kết luận :
Màng là một thành phần quan trọng và được sử dụng rộng rãi trong nha khoa cấy ghép. Chúng hoạt động như một hàng rào sinh học và cơ học chống lại sự xâm nhập của các tế bào không tham gia vào quá trình hình thành xương, cho phép di chuyển các tế bào tạo xương di cư chậm hơn vào các vị trí khuyết hổng. Màng được chia thành các loại không tiêu và có tiêu và có sẵn ở nhiều dạng khác nhau. Điều quan trọng là bác sĩ lâm sàng cấy ghép xác định sử dụng màng nào dựa trên các tình huống lâm sàng khác nhau cũng như các yếu tố như thành phần vật liệu và thời gian tự tiêu. Với nhiều lựa chọn màng sản xuất sẵn, việc lựa chọn cẩn thận sẽ hỗ trợ tái tạo mô cứng và mô mềm và cuối cùng là tăng tỷ lệ thành công của các thủ thuật GBR.
- Chou AH, LeGeros RZ, Chen Z, Li Y. Antibacterial effect of zinc phosphate mineralized guided bone regeneration membranes. Implant Dent. 2007 Mar;16(1):89-100.
- Nishibori M, Betts NJ, Salama H, Listgarten MA. Short-term healing of autogenous and allogeneic bone grafts after sinus augmentation: a report of 2 cases. J Periodontol. 1994 Oct;65(10):958-66.
- Pitaru S, Tal H, Soldinger M, Grosskopf A, Noff M. Partial regeneration of periodontal tissues using collagen barriers. Initial observations in the canine. J Periodontol. 1988 Jun;59(6):380-6.
- Zhang Y, Zhang X, Shi B, Miron RJ. Membranes for guided tissue and bone regeneration. Annals of Oral & Maxillofacial Surgery. 2013 Feb;1(1):10.
- Pocket Dentistry [internet]. Barrier membranes for guided bone regeneration; [updated 2015 Jan 5; cited 2017 Dec 28]. Available from: https://pocketdentistry.com/3-barrier-membranes-for-guided-bone-regeneration/#end_en139.
- Rispoli L, Fontana F, Beretta M, Poggio CE, Maiorana C. Surgery guidelines for barrier membranes in guided bone regeneration (GBR). J Otolaryngol Rhinol. 2015;1(2):1-8.
- Almazrooa SA, Noonan V, Woo SB. Resorbable collagen membranes: histopathologic features. Oral Surg Oral Med Oral Pathol Oral Radiol. 2014 Aug;118(2):236-40.
- Luitaud C, Laflamme C, Semlali A, Saidi S, Grenier G, Zakrzewski A, Rouabhia M. Development of an engineering autologous palatal mucosa-like tissue for potential clinical applications. J Biomed Mater Res B Appl Biomater. 2007 Nov;83(2):554-61.
- Yamada M, Kubo K, Ueno T, Iwasa F, Att W, Hori N, Ogawa T. Alleviation of commercial collagen sponge- and membrane-induced apoptosis and dysfunction in cultured osteoblasts by an amino acid derivative. Int J Oral Maxillofac Implants. 2010 Sep-Oct;25(5):939-46.
- Rothamel D, Schwarz F, Sager M, Herten M, Sculean A, Becker J. Biodegradation of differently cross-linked collagen membranes: an experimental study in the rat. Clin Oral Implants Res. 2005 Jun;16(3):369-78.
- Schwarz F, Rothamel D, Herten M, Wüstefeld M, Sager M, Ferrari D, Becker J. Immunohistochemical characterization of guided bone regeneration at a dehiscence-type defect using different barrier membranes: an experimental study in dogs. Clin Oral Implants Res. 2008 Apr;19(4):402-15.




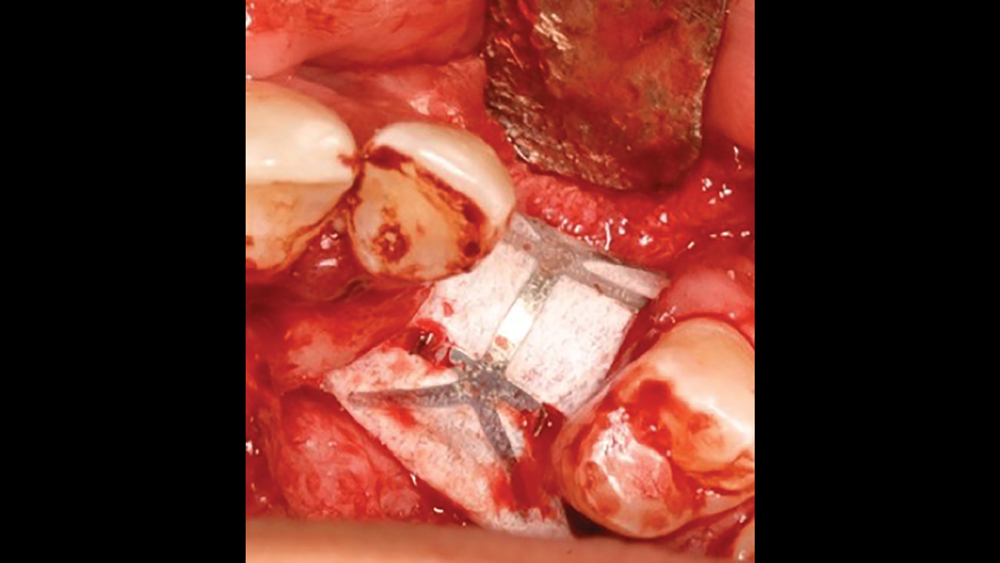 b. Màng lưới titan
b. Màng lưới titan